
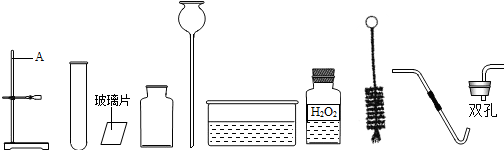
分析 Ⅰ.根据题目中提供的仪器、药品、实验的操作,结合氧气的实验室制法可以推测出甲抽到的是氧气的制取、收集;
Ⅱ.(1)根据不溶于液体的固体和液体分离的方法考虑;根据除杂质氯化钙的方法考虑;
(2)根据方程式的写法考虑;
(3)根据玻璃棒的用途考虑.
解答 解:Ⅰ.依据对实验室常用仪器的认识可知,如图1中仪器A的名称是铁架台,依据甲抽到的药品中有双氧水、长颈漏斗、水槽等,可以判断甲抽到的是③;该实验的反应是过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
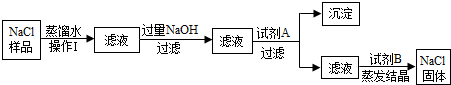
Ⅱ.(1)乙同学抽签后,监考老师告诉他:食盐样品中含有少量沙土、氯化钙和氯化镁,说明到的考题是①粗盐提纯;
沙土不溶于水,可以通过过滤,将沙土与液体分离开;加入试剂氢氧化钠是为了除去氯化镁,因为氢氧化镁是沉淀,加入试剂A是为了除去氯化钙,由于碳酸钙是沉淀,又不能引入新的杂质,所以加入碳酸钠溶液就行,碳酸钠与氯化钙反应生成碳酸钙沉淀;为了除去过量的氢氧化钠和碳酸钠,加入试剂稀盐酸;
(2)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,所以粗盐中除混有泥沙等难溶性杂志外,通常还含有MgCl2等可溶性杂质,为了除去MgCl2,可以加入的试剂是氢氧化钠溶液;因此反应物是氢氧化钠和氯化镁,生成物是氢氧化镁沉淀和氯化钠反应的方程式为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl;
碳酸钠与氯化钙反应生成碳酸钙沉淀,反应的方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl;
(3)蒸发结晶时用到玻璃棒的作用是搅拌,防止局部过热导致液滴飞溅.
答案:
Ⅰ.铁架台 ③2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
Ⅱ.
(1)①过滤 HCl
(2)2NaOH+MgCl2═Mg(OH)2↓+2NaCl
CaCl2+Na2CO3═CaCO3↓+2NaCl
(3)搅拌,防止局部过热导致液滴飞溅
点评 初中化学对于气体的实验室制法主要从药品、反应原理、发生装置、收集装置、检验、验满、及实验操作、注意事项等方面进行比较、归纳,进而总结实验室制取气体的一般思路和方法.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题

| 组别 | 样品质量 | CO2的体积 |
| 第1组 | 0.21g | 22.39mL |
| 第2组 | 0.21g | 22.41mL |
| 第3组 | 0.21g | 22.40mL |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
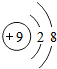 ⑤
⑤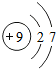
| A. | ①可表示液氮这种物质 | B. | ③属于氧化物 | ||
| C. | ②和④均表示阳离子 | D. | ⑤表示的微粒属于稀有气体元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶解前用玻璃棒研磨大颗粒粗盐 | |
| B. | 过滤时液体的液面要低于滤纸边缘 | |
| C. | 加热蒸发时要不断搅拌直至水分全部蒸干 | |
| D. | 实验结束随即用手将蒸发皿从铁架台的铁圈上取下 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 检验CaCl2中是否含有HCl:HCl+AgNO3═HNO3+AgCl↓ | |
| B. | 实验室制CO2气体:CaCO3+2HCl═CaCl2+H2O+CO2↑ | |
| C. | 铁和盐酸反应:2Fe+6 HCl═2FeCl3+3H2↑ | |
| D. | 铁丝在氧气中燃烧:4Fe+3O2 $\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com