现有30g某物质至于氧气中点燃,完全燃烧生成了二氧化碳和水.
(1)该物质中一定含有的元素是______,可能含有的元素是______;
(2)为了探究该物质中是否含有氧元素,对产物进行收集、称量,得到二氧化碳和水的质量分别为44g和36g.则该物质中______(“含有”或“不含有”)氧元素.
解:(1)根据质量守恒定律,在化学反应前后元素的种类没有改变,生成物二氧化碳、水中含有C、H、O元素,则反应物中也一定含有这三种元素.物质在空气中燃烧是和空气中的氧气反应,氧气由O元素组成,则C、H定是从某物质中来,而某物质中也可能含有O元素.
(2)生成物中C元素的质量=44g×
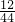
=12g;
生成物中H元素的质量=36g×
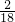
=4g;
因为12g+4g=16g<30g,所以该物质中一定含有O元素.
故答案为:(1)碳、氢;氧;(2)含有.
分析:(1)根据质量守恒定律,在化学反应前后元素的种类没有改变来推断.
(2)根据“得到二氧化碳和水的质量分别为44g和36g”和二氧化碳中C元素的质量分数和水中H元素的质量分数,计算出生成物中C元素的质量与H元素的质量,两者之和与30g进行比较即可得出结论.
点评:本题主要考查学生运用质量守恒定律进行推断的能力,难度不大.

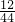 =12g;
=12g;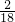 =4g;
=4g;

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案