
| A. | 镁+氧气$\stackrel{点燃}{→}$氧化镁 | B. | 甲烷+氧气$\stackrel{点燃}{→}$二氧化碳+水 | ||
| C. | 碳酸氢铵$\stackrel{加热}{→}$氨气+二氧化碳+水 | D. | 硫+氧气$\stackrel{点燃}{→}$二氧化硫 |
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
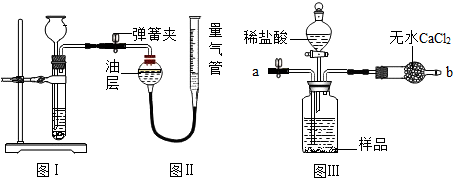
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
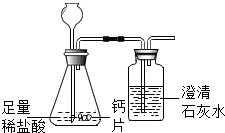 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com