氯化铁是一种重要的铁盐,广泛用于造纸、印染等污染处理.
【物质制备】某兴趣小组同学查找到以黄铁矿(主要成分是二硫化亚铁,化学式为FeS
2)为主要原料制备氯化铁晶体的工业生产过程:
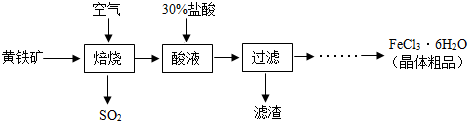
(1)黄铁矿是
物(填“纯净”或“混合”),其中二硫化亚铁中铁元素的化合价为
.
(2)焙烧过程主要发生以下化学反应,配平化学方程式:FeS
2+O
2 Fe
2O
3+SO
2【含量测定】(3)该过程产生的尾气中含有HCl等气体,可用
溶液来吸收(填化学式).
在上述流程中产生的SO
2气体可用于工业上生产硫酸,该兴趣小组的同学为测定某黄铁矿中硫元素的含量进行了如下的实验探究.
已知亚硫酸钠与过氧化氢反应能生成硫酸钠和水.(假设每步反应均完全,不考虑装置内原有空气对测定结果的影响)
甲、乙二个实验小组均设计了下列装置,称取了m
1g黄铁矿样品,将样品放入如图所示的硬质粗玻璃管中,从a处不断地缓缓通入空气,高温灼烧玻璃管中的黄铁矿样品至反应完全.
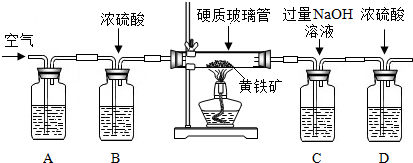
甲组同学仅称量了上述实验所需要的相关装置质量后即完成了测定.
乙组同学则在上述反应结束后,将C瓶中的溶液进行了如图的处理:
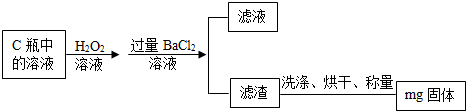
问题讨论:
(4)上述装置中A瓶内所盛的试剂最好是
溶液,其作用是
.A、B装置能否对调位置
?(填“能”或“否”)
(5)气体进入C瓶后,C瓶中发生反应的化学方程式为
,该反应是否属于基本反应类型
(填“是”或“否”).
(6)甲组同学应称量的数据是
(填编号).
①反应前C装置及其中物质总质量m
2g
②反应前C、D装置及其中物质总质量m
3g
③反应后C装置及其中物质总质量m
4g
④反应后C、D装置及其中物质总质量m
5g
(7)根据(6)中所选数据,甲组同学测得的该黄铁矿中硫元素的质量分数的表达式为
.
(8)乙组同学最终得到的固体的化学式为,检验所加BaCl
2溶液是否过量的方法是,乙组的实验过程中洗涤滤渣的目的是,若未洗涤就直接烘干称量,则会使测定结果
(填“偏大、偏小或不变”),检验滤渣是否洗净所用试剂是
溶液,该小组测定的硫元素的质量分数的表达式为
.