
 如图是A、B两种固体物质的溶解度曲线.
如图是A、B两种固体物质的溶解度曲线.分析 (1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)根据t1℃时A物质的溶解度小于B物质的溶解度进行解答;
(3)据饱和溶液中溶质的质量分数及AB的溶解度随温度升高而增大进行解答;
(4)不饱和溶液变为饱和溶液可采取增加溶质、蒸发溶剂、降温的方法,据此结合选项解答;
(5)据配制一定质量分数所需仪器解答;
(6)据溶解度曲线可知某温度下物质的溶解度;
(7)根据物质的溶解度曲线可知物质的溶解度随温度变化趋势;
(8)据物质的溶解度随温度变化可分析提纯物质的方法;
(9)等质量的饱和溶液降低相同的温度,溶解度变化大的析出晶体多.
解答 解:(1)a点是t2℃时AB的溶解度曲线的交点,表示二者的溶解度相等.
(2)t1℃时B的溶解度大于A的溶解度,即等质量的水中最多溶解的B的质量大于A,所以将等质量的A、B两种物质加水溶解配制成饱和溶液,所得溶液质量A大于B;
(3)饱和时溶液中溶质质量分数的计算式是$\frac{溶解度}{溶解度+100g}$×100%,将t2℃时A、B的饱和溶液分别升温到t3℃,t2℃时二者的溶解度相等,溶质的质量分数相等,升温后二者的溶解度增大,溶液中溶质、溶剂的质量不变,故所得溶液中溶质的质量分数仍是A=B.
(4)A、将A物质的不饱和溶液变为饱和溶液,溶剂的质量不一定变小,例如降低温度至恰好饱和,故A错误;
B、将A物质的不饱和溶液变为饱和溶液,溶质的质量可能不变,例如降低温度恰好变为饱和溶液,故B正确;
C、将A物质的不饱和溶液变为饱和溶液,溶质的质量分数可能不变,例如降低温度恰好变为饱和溶液,故C错误;
D、溶液的质量可能不变,例如降低温度恰好变为饱和溶液,故D错误;
E、该饱和溶液是指不能再溶解该物质,但是还可以再溶解其他物质,故E正确;故选:BE;
(5)通常情况下,在实验室用固体A配制一定溶质质量分数的甲溶液,需用到的仪器有:托盘天平(带珐码盒)、烧杯和药匙、量筒、胶头滴管、玻璃棒;
(6)由图可知:t1℃时A物质的溶解度是25g;
(7)由图可知:B的溶解度受温度影响小;
(8)A的溶解度受温度影响较大,B的溶解度受温度影响较小,所以当A中含有少量B物质时,可采用冷却热饱和溶液或降温结晶的方法提纯A物质.
(9)把t2℃时,等质量A、B两物质的饱和溶液降低到t1℃,A的溶解度变化大,析出晶体较多.
故答案为:
(1)t2℃时AB的溶解度相等;(2)>;(3)等于;(4)BE;(5)BCFG;(6)25;(7)B;(8)降温结晶(或冷却热饱和溶液);(9)A.
点评 根据溶解度曲线可知某温度下物质的溶解度,比较同一温度下不同物质的溶解度大小,物质的溶解度随温度变化情况、物质的分离和提纯等,并能据题意灵活分析解答,能较好考查学生分析、解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | 物质的量是表示一定数目微粒的集合体 | |
| C. | 1个碳原子的质量是12g | |
| D. | 物质的量就是物质的质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
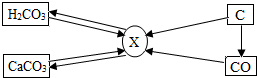 碳和部分碳的化合物间转化关系如图所示.
碳和部分碳的化合物间转化关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若丙、丁为盐和水,则甲、乙一定是酸和碱 | |
| B. | 若将10g甲和15g乙混合,充分反应后,则生成丙和丁的质量总和一定为25g | |
| C. | 若甲、乙、丙、丁都是化合物,则该反应一定是复分解反应 | |
| D. | 若甲为碳水化合物,乙为氧气,则该反应一定为氧化反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
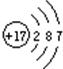 ,它在化学反应中容易得到电子变成阴离子,属于非金属元素(填金属或非金属);Na元素的离子结构示意图为:
,它在化学反应中容易得到电子变成阴离子,属于非金属元素(填金属或非金属);Na元素的离子结构示意图为: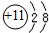 ,该离子带1个单位正电荷,该元素属于金属元素(填金属或非金属).
,该离子带1个单位正电荷,该元素属于金属元素(填金属或非金属).查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水凝结成冰后,冰分子静止不动 | |
| B. | 瘪乒乓球受热恢复原形,是因为气体分子间隔变大了 | |
| C. | 电解水实验说明在化学变化中分子可以再分 | |
| D. | 白糖在水中溶解不见了,是因为糖分子运动到水分子间隔中了 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com