
 探究影响化学反应速率的因素
探究影响化学反应速率的因素| 观察或测量的量 | 选用的仪器 | 实验步骤 | 实验现象 | 实验结论 |
| 产生相同体积(一试管)的气体所需时间 | 气体发生装置、秒表、胶头滴管、水槽、大试管、 药匙、量筒 | 温度越高,反应速率越快.反应的化学方程式是Zn+H2SO4═ZnSO4+H2↑ |
分析 (1)根据物质的结构决定物质的性质,结合促进物质燃烧的因素,进行分析解答.
(3)由实验目的:温度对反应速率的影响;提供的药品:颗粒大小相同的锌粒,两份相同溶质质量分数,不同温度的稀硫酸(20℃、40℃);供选仪器:利用控制变量法,可以比较收集等体积气体所需的时间,确定温度对反应速率的影响,进行分析解答.
(4)根据温度升高,微观粒子运动的速率加快,进行分析解答.
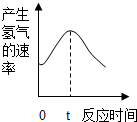
(5)由锌粒与稀硫酸反应产生氢气的速率随时间变化的曲线图,根据金属与酸的反应属于放热反应,
解答 解:(1)镁在空气中能够剧烈燃烧,铁丝在氧气中能够剧烈燃烧,而真金不怕火炼,金属不同,燃烧的现象不同,这说明决定物质之间能否发生反应以及反应速率的内因是:反应物本身的性质;物质的结构决定物质的性质,或者是反应物的组成、结构等.
蜡烛在氧气中燃烧比在空气中燃烧剧烈,空气中氧气难度比氧气中的低,故这一事例中影响化学反应速率的因素是氧气的浓度.
(3)可利用控制变量法,其它条件相同,温度不同,测定产生相同体积(一试管)的气体所需时间,来确定温度多反应速率的影响.可选用气体发生装置、秒表、胶头滴管、水槽、大试管、药匙(取用锌粒)、量筒(量取生成氢气的体积),可分别取相同数量、大小的锌粒于气体发生装置中,分别取相同体积、不同温度的稀硫酸加入到两套气体发生装置中,记录收集等体积气体所需的时间,温度高的,收集等体积气体所需的时间短,说明温度越高,反应速率越快;锌与稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑.
该实验可以观察或测量的量有多种,除了上述观测点外,可以观察或测量的量还有相同时间内收集气体的体积或反应结束所需的时间或消耗等量的锌粒所需的时间或消耗等量的稀硫酸所需的时间等.
(4)从微观的角度,“温度越高,反应速率越快”,是因为温度升高,粒子的运动的速率加快,有效碰撞机会增加.
(5)由锌粒与稀硫酸反应产生氢气的速率随时间变化的曲线图,0-t内,锌与稀硫酸反应放热,温度升高,反应速率加快.
时间t以后,随着反应的进行,硫酸的质量减少,反应物的浓度越来越小,反应速率减慢.
故答案为:(1)反应物本身的性质(或反应物的组成、结构等);氧气的浓度;
(3)
| 观察或测量的量 | 选用的仪器 | 实验步骤 | 实验现象 | 实验结论 |
| 产生相同体积(一试管)的气体所需时间 | 气体发生装置、秒表、胶头滴管、水槽、大试管、 药匙、量筒 | 分别取相同数量、大小的锌粒于气体发生装置中,分别取相同体积、不同温度的稀硫酸加入到两套气体发生装置中,记录收集等体积气体所需的时间 | 温度高的,收集等体积气体所需的时间短 | 温度越高,反应速率越快.反应的化学方程式是 Zn+H2SO4═ZnSO4+H2↑ |
点评 本题有一定难度,探究影响化学反应速率的因素,熟练金属的化学性质、控制变量法等并能灵活运用是正确解答本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
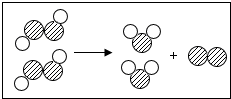 如图为某反应的微观示意图.图中“
如图为某反应的微观示意图.图中“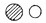 ”代表不同元素的原子.下列对图示反应的理解中,错误的是( )
”代表不同元素的原子.下列对图示反应的理解中,错误的是( )| A. | 反应前后分子种类发生了改变 | |
| B. | 该反应中的各物质的分子个数比为1:1:1 | |
| C. | 该反应前后原子的种类和数目都未改变 | |
| D. | 该反应属于分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
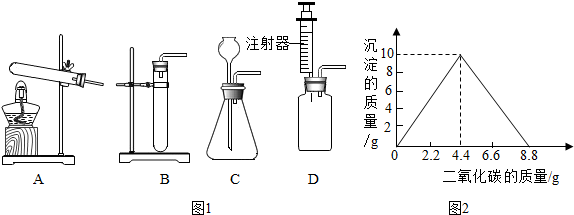
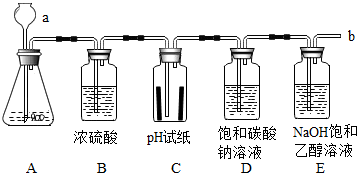 某学习小组用下列装置进行CO2的制取及性质探究实验.
某学习小组用下列装置进行CO2的制取及性质探究实验.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
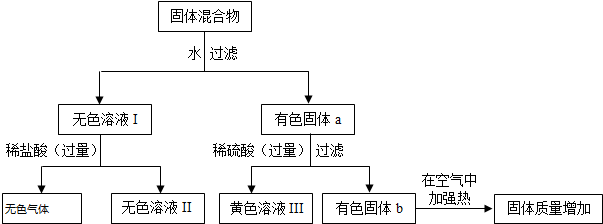
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com