
| A. | 一定是纯净物 | B. | 一定是混合物 | C. | 可能是混合物 | D. | 可能是纯净物 |
分析 根据气体中含有C、O元素,碳、氧两种元素组成的气体有二氧化碳、一氧化碳、氧气等;先计算CO和CO2中C与O元素的质量比,根据混合气体中碳、氧两种元素的质量比为3:5,分析其组成.
解答 解:根据气体中含有C、O元素,假设气体全为CO,则CO中C、O元素的质量比为12:16=3:4,不可能.
假设气体全为CO2,则CO2中C、O元素的质量比为12:16×2=3:8,不可能.
若气体为一氧化碳和二氧化碳的混合气体,则混合气体中碳、氧两种元素的质量比可能等于3:5.
又因为氧气中不含碳元素,氧气的存在只能够使C与O元素的质量比的数值变小,则要满足混合气体中碳、氧两种元素的质量比为3:5,混合气体中必须含有CO,即气体也可能为CO、O2或CO、CO2、O2.
故选:B.
点评 本题有一定难度,考查混合气体成分的确定,熟悉含碳、氧元素组成的气体、学会利用极限法和平均值法是解答本题的关键.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:初中化学 来源: 题型:解答题
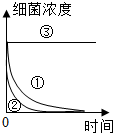 次氯酸钠溶液,俗称漂白水,在烧碱溶液中通入氯气即可制得.漂白水为无色或淡黄绿色液体,
次氯酸钠溶液,俗称漂白水,在烧碱溶液中通入氯气即可制得.漂白水为无色或淡黄绿色液体,| 编号 | 实验目的 | 温度/℃ | pH | 光照/lx |
| ① | 为②③提供对照 | 25 | 5 | 300 |
| ② | 探究温度对杀菌速率的影响 | 10 | 5 | 300 |
| ③ | 探究光强对杀菌速率的影响 | 10 | 5 | 80000 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com