
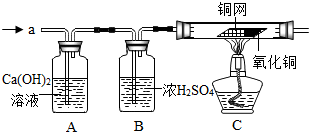
分析 【提出猜想】根据质量守恒定律分析;
【方案设计】根据二氧化硫和氢氧化钙溶液反应微溶于水的亚硫酸钙和水以及氧气和铜反应生成黑色的氧化铜进行解答;
【实验探究】①根据该实验中氢气属于可燃性气体,不纯加热可能会发生爆炸进行解答;
【实验结论】①根据实验现象可知该气体是氢气进行解答;
②根据铝和硫酸铜溶液反应生成铜和硫酸铝进行解答;
【实验反思】根据二氧化硫不燃烧也不支持燃烧,能使燃着的木条熄灭;氧气具有助燃性,能使燃着的木条燃烧更旺;氢气具有可燃性,能燃烧进行解答.
解答 解:【提出猜想】根据质量守恒定律,反应前后元素种类不变,反应前不含碳元素,反应后也不会有,所以不可能含有二氧化碳;
【方案设计】二氧化硫和氢氧化钙溶液反应微溶于水的亚硫酸钙和水,所以如果A中石灰水变浑浊,则气体为SO2;氧气和铜反应生成黑色的氧化铜,所以如果C中红色的铜网变黑,则气体为O2;
【实验探究】①该实验中氢气属于可燃性气体,不纯加热可能会发生爆炸,所以实验开始时,应先将收集到的气体从a处通入一段时间后,再点燃C处酒精灯;
【实验结论】①实验过程中发现A装置中溶液不变浑浊,说明不是二氧化硫,C装置中表面含CuO的铜网由黑色变为光亮的红色,试管壁上有水滴生成,所以铁粉与该硫酸铜溶液反应时,产生的气体是氢气;
②铝和硫酸反应生成氢气和硫酸铝,铝和硫酸铜溶液反应生成铜和硫酸铝,发生反应的化学方程式为2Al+3H2SO4=Al2(SO4)3+3H2↑,2Al+3CuSO4=Al2(SO4)3+3Cu;
【实验反思】铝片表面有氧化铝膜,阻止铝与其他物质发生反应,所以实验前一定先用砂纸打磨;
二氧化硫不燃烧也不支持燃烧,能使燃着的木条熄灭;氧气具有助燃性,能使燃着的木条燃烧更旺;氢气具有可燃性,能燃烧,所以乙同学的实验方案是收集一瓶气体,将燃着的火柴伸入瓶中,若火柴熄灭,则为SO2;若火柴燃烧更旺,则为O2;若气体被点燃,则为H2.
故答案为:
【提出猜想】CO2;根据质量守恒定律,反应前后元素种类不变,反应前不含碳元素,反应后也不会有
【方案设计】A中石灰水变浑浊;C中红色的铜网变黑
【实验探究】排尽装置内的空气,防止气体不纯发生爆炸
【实验结论】①氢气
②2Al+3H2SO4=Al2(SO4)3+3H2↑
或 2Al+3CuSO4=Al2(SO4)3+3Cu
【实验反思】铝片表面有氧化铝膜;
收集一瓶气体,将燃着的火柴伸入瓶中,若火柴熄灭,则为SO2;若火柴燃烧更旺,则为O2;若气体被点燃,则为H2.
点评 本题主要考查化学实验的方案设计与评价,在解此类题时,首先分析题中考查的问题,然后结合所给的知识和学过的知识进行分析解答.


科目:初中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 判断 | 依据 |
| 不是KMNO4 | KMnO4能溶于水形成紫红色溶液 |
| 不是K2MNO4 | 冲洗试管时出现深绿色溶液,说明该物质能溶于水 |
| 是MnO2 | 其他实验用过MnO2,知道它是不溶于水的黑色固体 |
 由是都是金属氧化物.已知这种物质能与稀盐酸反生成氯化物和水(反应前后化合价不变),化学方程式为Fe2O3+6HCl=3H2O+2FeCl3,由此推测MnO2也能与稀盐酸反应.
由是都是金属氧化物.已知这种物质能与稀盐酸反生成氯化物和水(反应前后化合价不变),化学方程式为Fe2O3+6HCl=3H2O+2FeCl3,由此推测MnO2也能与稀盐酸反应.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
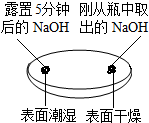 | 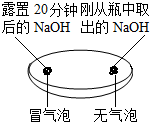 | 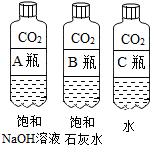 |
| 实验一 | 实验二 | 分析 |
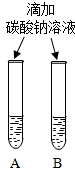 | 微热(不考虑水分蒸发)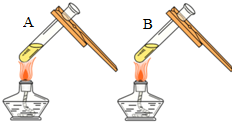 | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为饱和氢氧化钙溶液;;方案二的设计原理是氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大. |

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com