
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去。 | ||||
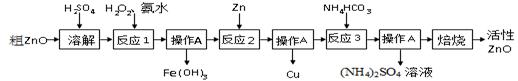
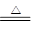 ZnO+CO2↑ Zn(OH)2
ZnO+CO2↑ Zn(OH)2 ZnO+H2O
ZnO+H2O 
| | 装置C的质量(/g) | 装置D的质量(/g) |
| 实验前 | 198.4 | 235.7 |
| 实验后 | 209.2 | 244.5 |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:初中化学 来源:不详 题型:问答题
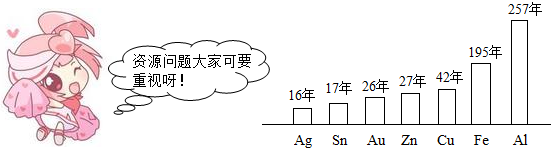
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.对废旧电池中汞的回收可以减轻环境污染 |
| B.铝表面的致密氧化膜可以阻止铝进一步氧化 |
| C.经常用水冲洗铁制品表面可以防止铁生锈 |
| D.Ag、Mg、ZnSO4溶液可用来探究镁锌银的活动性顺序 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| 序号 | 物质 | 杂质(少量) | 试剂和操作方法 |
| A | O2 | H2O | 通过浓H2SO4,洗气 |
| B | Cu(NO3)2溶液 | AgNO3溶液 | 加入过量的铜粉,过滤 |
| C | NaOH溶液 | Na2CO3溶液 | 加入适量的CaCl2溶液,过滤 |
| D | 稀盐酸 | 稀硫酸 | 加入适量BaCl2溶液,过滤 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液放在试管中,再滴入氯化钙溶液 | 若生成白色沉淀 | 碳酸钠过量 |
| 若无明显现象 | 恰好反应 |
| 实验步骤 | 实验现象和结论 |
| | |
| |
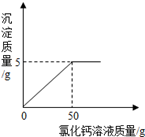
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.在某固体中滴加稀盐酸,有气泡产生一一该固体一定是碳酸盐 |
| B.在无色溶液中滴入酚酞试液,溶液变红色——该溶液一定是碱溶液 |
| C.向饱和硫酸铵溶液中加入鸡蛋清,产生白色絮状沉淀——蛋白质变性 |
| D.生石灰块投入水中,水会沸腾——生石灰变成熟石灰的过程是放热反应 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| 选项 | 物质 | 杂质(少量) | 试 剂 | 操作方法 |
| A | Cu | CuO | O2 | 加热 |
| B | 氯化钙溶液 | 盐酸 | 过量的碳酸钙 | 过滤 |
| C | 氯化钠 | 纯碱 | 适量的稀盐酸 | 溶解、过滤、蒸发 |
| D | H2O | 悬浮物 | 明矾 | 吸附 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com