
分析 本题考查利用纯净物的概念来判断物质是否为纯净物,宏观上看只有一种物质,微观上只有一种分子.
解答 解:①海水中含有氯化钠、氯化镁、水等物质,属于混合物;②氧气是由一种物质组成,属于纯净物;③豆浆中含有蛋白质、油脂等物质,属于混合物;④五氧化二磷是由一种物质组成,属于纯净物;⑤冰水混合物是由水一种物质组成,属于纯净物;⑥苹果汁饮料中含有维生素C、水、碳酸等物质,属于混合物;⑦铁粉是由铁一种物质组成,属于纯净物;⑧矿泉水中含有水和多种矿物质,属于混合物;⑨呼出的气体中含有二氧化碳、水、氧气等物质,属于混合物;⑩铝箔是由铝一种物质组成,属于纯净物.
故答案为:②④⑤⑦⑩;①③⑥⑧⑨.
点评 在熟悉概念的基础上能从宏观和微观两个方面来判断纯净物和混合物,还要从社会实践中了解生活中常见物质的组成.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 22.2 g | B. | 20 g | C. | 17.8 g | D. | 2.2 g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 纯碱 NaOH 盐 | B. | 生石灰 CaO 氧化物 | ||
| C. | 熟石灰 氢氧化钙 碱 | D. | 烧碱 NaOH 碱 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
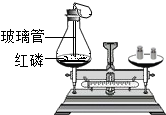 质量守恒定律的探究实验(一)--红磷燃烧实验.实验装置如图.
质量守恒定律的探究实验(一)--红磷燃烧实验.实验装置如图.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
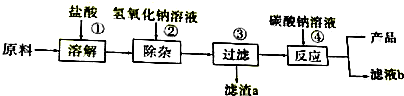
| 实验操作步骤 | 实验现象 | 结论 |
| 步骤一:另取少量滤液于另一支试管中,滴加碳酸钠溶液. | 实验过程中产生白色沉淀. | 猜想2正确 |
| 步骤二:取少量滤液于试管中,滴加稀盐酸,振荡. | 无明显现象 | 猜想3不正确. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com