
【题目】氢气燃烧能放出大量的热,且生成物只有水,“氢能”将是未来最理想的新能源,氢气的制备和储存成为研究的热点。
(1)最理想的制氢方法:在合适的催化剂作用下,利用太阳光使水分解。该制氢过程__(选填“吸收”或“放出”)能量,生成的氢气与氧气在相同条件下的体积之比为_______。
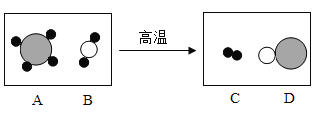
(2)下图是工业上制备氢气的微观示意图,其中不同的球代表不同的原子,则氢分子是___(填字母),该反应中A、D两物质的分子个数比是_____。
(3)某化学家根据“原子经济”的思想设计制备氢气的反应步骤如下图:
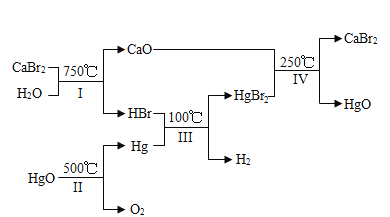
①图中Ⅳ反应属于复分解反应,写出该反应的化学方程式:_____。
②在整个流程中,可循环利用的物质有_______。
(4)我国稀土资源丰富,某种稀土储氢材料(用M表示)的储氢原理可表示为![]() 。 M的化学式为_______。
。 M的化学式为_______。
【答案】吸收 2: 1 C 1:1 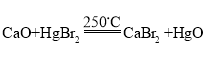 HgO和CaBr2 LaNi5
HgO和CaBr2 LaNi5
【解析】
(1)利用太阳光使水分解时,消耗的光能贮存在生成的氢气中,所以利用太阳光使水分解得到氢气的反应是一个吸收能量的过程,故填吸收;
由电解水的实验可知,分解水后生成的氢气与氧气在相同条件下的体积之比为2:1,故填2:1。
(2)1个氢分子是由2个氢原子构成的,所以图中表示氢分子的是C,故填C;
化学反应前后各元素的原子数目不变,所以该反应的化学方程式可以表示为A+B![]() 3C+D,z则该反应中A、D两物质的分子个数比是1:1,故填1:1。
3C+D,z则该反应中A、D两物质的分子个数比是1:1,故填1:1。
(3)①由图可知,反应IV是氧化钙与溴化汞在250° C时反应生成溴化钙和氧化汞,故反应的化学方程式写为:CaO+HgBr2![]() CaBr2+HgO;
CaBr2+HgO;
②由流程图可知,开始时参加反应的CaBr2和HgO在流程的最后又重新生成,所以CaBr2和HgO在流程中可以循环使用,故填CaBr2和HgO。
(4)由反应的原理可知,反应前只出现了6个H原子,反应后出现了1个La原子、5个Ni原子和6个H原子,根据质量守恒定律的原因可知,尚缺的1个La原子和5个Ni原子存在于M中,所以M的化学式写为LaNi5,故填LaNi5。


科目:初中化学 来源: 题型:
【题目】下列实验现象不正确的是
选项 | A | B | C | D |
实验 |
|
|
|
|
实验现象 | 剧烈燃烧,火星四射,放出大量的热,生成黑色固体 | 出现白色浑浊 | 溶液由无色变为红色 | 产生气泡,溶液变为浅绿色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究碱的性质,进行如下实验。
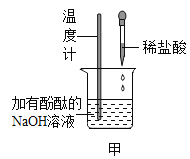
(1)如甲图所示,加入一定量的盐酸后,溶液红色褪去,反应过程中溶液温度是____________ (填“升高”或“降低”),反应的化学方程式为______________。
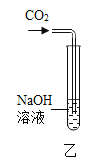
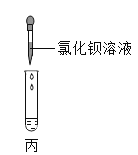
(2)乙图所示,在NaOH溶液中通入CO2,然后滴加氯化钡溶液(呈中性)如丙图。有白色沉淀产生。说明NaOH与CO2发生了反应,则乙中反应的化学方程式为____________________;丙中反应的化学方程式为______________。
(3)实验结束后废液处理。实验结束后将试管丙内所有物质全部倒入一大烧杯中,再将甲烧杯所得溶液缓慢加入,全部加入充分搅拌后测得溶液pH为3。在将甲烧杯所得溶液缓慢加入的过程中,大烧杯内可观察到的现象是_________________。最终大烧杯中除了酚外,还含有的溶质是_________________。最后,调节pH接近7,达到排放标准。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学设计的工业制备氢氧化钠的流程如下图。
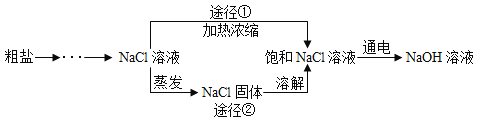
资料: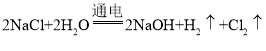 ,两电极,一端得到NaOH和H2,另一端得到Cl2。
,两电极,一端得到NaOH和H2,另一端得到Cl2。
(1)实验室进行蒸发操作时用到的仪器有铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒和________,蒸发过程中用玻璃棒不断搅动的目的是_________。
(2)Cl2可用于生产84消毒液(有效成分NaClO),反应原理为![]() ,X的化学式为_______,反应前后氯元素的化合价共有________种。
,X的化学式为_______,反应前后氯元素的化合价共有________种。
(3)加热浓缩过程中(没有晶体析出),溶液中始终没有发生改变的量是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室以某石灰石(含少量Fe2O3和SiO2)为原料制备较纯的碳酸钙的实验流程。 已知:SiO2不溶于水也不与酸反应。请你根据流程回答下列问题:
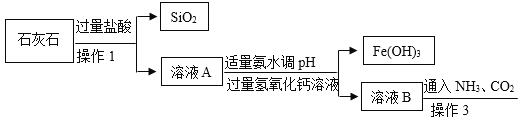
(1)操作1中需要用到的玻璃仪器有烧杯、玻璃棒和__________。
(2)在石灰石中加入稀盐酸,而不能用稀硫酸代替的原因是__________。
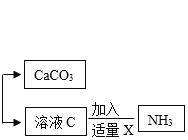
(3)用上述的流程制备碳酸钙,为了后期便于综合回收利用且不带入更多的新杂质,因此 向溶液C中加入___________(填写化学式),加热,则可回收氨气(NH3)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图是甲、乙两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是
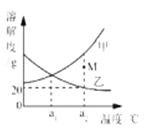
A.甲的溶解度大于乙的溶解度
B.a1℃时,甲、乙饱和溶液的温度升温至a2℃时,均有固体析出
C.a2℃时,M点对应的甲溶液不饱和
D.a2℃时,乙饱和溶液的质量分数为20%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某同学设计的实验室制取二氧化碳并验证其性质的实验装置图。
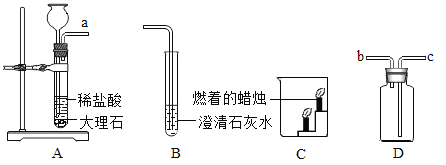
请回答下列问题:
(1)将A、B装置连接,可检验二氧化碳,该反应的实验现象为:_____。用D装置收集满一瓶二氧化碳气体,取下双孔橡皮塞.将瓶中的气体沿C装置烧杯左侧内壁缓慢倒入,观察到的现象时____,这些现象说明二氧化碳具有的性质是_____。
(2)反应制取的二氧化碳气体中常混有少量水蒸气,可通过盛有____的D装置,贝该混合气体应从D装置的______口(填“b”或“c”)通入。
(3)一氧化碳与二氧化碳组成元素相同, 但性质差异很大,如一氧化碳具有还原性,而二氧化碳却没有,其原因是_____。下图是某同学利用一氧化碳的还原性,设计的一氧化碳与氧化铁反应的实验装置图.请回答:
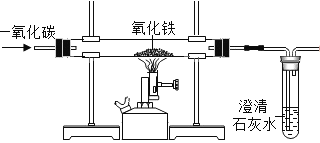
①实验一段时间后,玻璃管内观察到的现象是_____,反应的化学方程式是_______。
②请指出该装置的不足之处是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
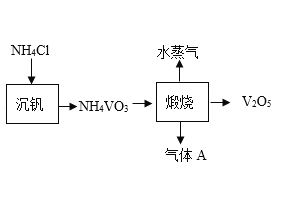
【题目】五氧化二钒(V2O5)是一种重要的化工催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分有V2O5、V2O4、K2SO4、Fe2O3、Al2O3和SiO2等,其中SiO2既不溶于水也不溶于H2SO4.以下是一种回收V2O5的工艺路线:
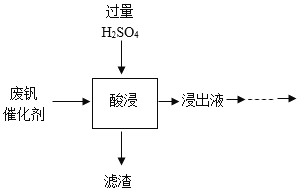
(1)“酸浸”时V2O5转化为(VO2)2SO4.写出V2O5和H2SO4发生反应的化学方程式_____。
(2)滤渣的主要成分为_____。
(3)“煅烧”中生成的H2O和V2O5的化学计量数之比为1:1.该反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】建立“宏观-微观”之间的联系,是化学学习的重要方法。请根据图示回答下列问题:
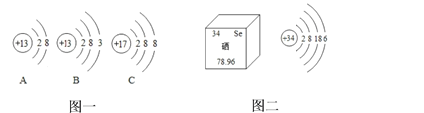
(1)A、B、C中属于阳离子的是________(填字母序号),其离子符号为_________
(2)硒元素被科学家称为“抗癌之王”,科学界研究发现血硒水平的高低与癌的发生息息相关。如图二是硒元素的相关信息,硒元素属于___________(填“金属”或“非金属”)元素,硒与元素周期表中第二周期的_________(填元素名称)化学性质相似,硒元素和钠元素组成化合物的化学式为_________
(3)下图是某个反应的微观示意图:
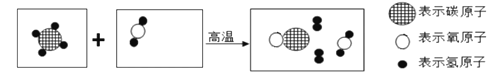
①请将图示后两个方框中的微观粒子示意图补画完全,使反应成立。__________________
②请用化学方程式表示该反应______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com