考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,二氧化碳的实验室制法,有关溶质质量分数的简单计算,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:溶质质量分数与化学方程式相结合的计算,常见气体的实验室制法、检验、干燥与净化
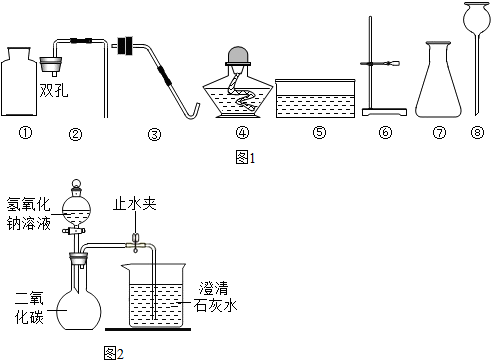
分析:(1)根据提供的药品和仪器选择;
(2)实验室制取氧气的反应原理是:采用分解过氧化氢溶液、加热氯酸钾或加热高锰酸钾.
(3)实验室制取二氧化碳的反应原理是:利用石灰石和稀盐酸在常温下反应来制取二氧化碳;
(4)根据二氧化碳和氢氧化钙的性质来判断反应现象;氢氧化钠溶液是足量的,因此溶液中的溶质一定有氢氧化钠;
【进行实验】根据二氧化碳、石灰水的性质进行分析;
【交流反思】①根据化学方程式的书写方法进行分析;
②氢氧化钠和生成的碳酸钠溶液都显碱性,都能使无色酚酞溶液变红;
③碳酸钠溶液、碳酸钾溶液等与氢氧化钙反应产生白色沉淀.
【延伸拓展】根据化学反应方程式,利用碳酸钡的质量计算出碳酸钠的质量,最后利用质量分数公式计算即可.
解答:解:(1)常温下制取氧气应用过氧化氢溶液和二氧化锰,应选择的仪器有集气瓶、锥形瓶、双孔橡皮塞和长颈漏斗;
(2)如果用氯酸钾和二氧化锰制氧气就需要加热,需要补充一种仪器是试管;氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可;
(3)实验室用石灰石和稀盐酸反应制取二氧化碳,反应的化学方程式是 CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑.
(4)二氧化碳可以和氢氧化钠反应,所以将氢氧化钠溶液滴入二氧化碳中,由于消耗了二氧化碳而使锥形瓶中气体压强变小,从而使试管中的石灰水进入锥形瓶,氢氧化钙溶液可以和二氧化碳或是碳酸钠反应生成碳酸钙沉淀,所以锥形瓶中的溶液要变浑浊;
氢氧化钠溶液是足量的,因此溶液中的溶质一定有氢氧化钠,因此猜想Ⅳ错误;
【进行实验】取少量烧瓶中液体于试管中,向其中通二氧化碳气体,没有白色沉淀,说明溶液中没有氢氧化钙,猜想Ⅲ错误;取少量烧瓶中液体于试管中,向其中加适量石灰水,产生白色沉淀,说明猜想Ⅱ成立;
【交流反思】
①烧瓶内充满CO
2,滴加氢氧化钠溶液后,氢氧化钠和二氧化碳反应生成碳酸钠和水;氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠;
②氢氧化钠和生成的碳酸钠溶液都显碱性,都能使无色酚酞溶液变红,因此a操作和结论肯定是错误的;
③碳酸钠溶液、碳酸钾溶液等与氢氧化钙反应产生白色沉淀.
【延伸拓展】
将烧瓶中液体经过滤后,取20g这种溶液,向其中加入稍过量的氯化钡溶液,将沉淀过滤、洗涤干燥,得到3.94g固体.请你计算该溶液中碳酸钠的质量分数是多少?
解:设该溶液中碳酸钠的质量是x,则
BaCl
2+Na
2CO
3═BaCO
3↓+2NaCl
106 197
x 3.94g
=
解得x=2.12g
该溶液中碳酸钠的质量分数是
×100%=10.6%
故答案为:(1)①②⑦⑧;(2)试管;2KClO
32KCl+3O
2↑;(3)CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;(4)有石灰水吸入平底烧瓶,烧瓶中液体变浑浊;【猜想】Ⅳ;【进行实验】Ⅲ;有白色沉淀;【交流反思】①Ca(OH)
2+Na
2CO
3=CaCO
3↓+2NaOH或Ca(OH)
2+CO
2=CaCO
3↓+H
2O;②a;③Na
2CO
3;【延伸拓展】10.6%.
点评:利用所给的仪器和药品来制取气体时,首先考虑制取某种气体用到什么药品,所给药品中是否有,如果有了再考虑用到什么仪器,所给的仪器中是否都有,按照这样的思路考虑.



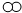 ”和“
”和“ ”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下: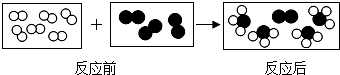
 化学基础知识是学好化学的关键,请按下列要求填空.
化学基础知识是学好化学的关键,请按下列要求填空. ,下列说法不正确的是( )
,下列说法不正确的是( )