
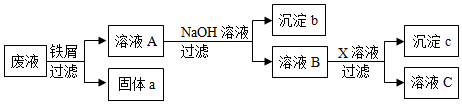
| A. | 固体a是铜 | |
| B. | X一定是Na2SO4 | |
| C. | 溶液B中含有的盐有Ba(NO3)2、NaNO3 | |
| D. | 若回收到6.4g固体a,则加入的铁屑质量为5.6g |
分析 根据铁的金属活动性大于铜,向废液中加入过量的铁屑,铁能与硝酸铜反应生成了铜和硝酸亚铁,过滤时得到的固体a中应含有铁和铜,向滤液中加入氢氧化钠时,硝酸亚铁能与氢氧化钠反应生成了氢氧化亚铁沉淀和硝酸钠,氢氧化亚铁在空气中已被氧化为氢氧化铁;为了除去钡离子,应加入硫酸钠、碳酸钠等.据此分析判断有关的问题.
解答 解:由于铁的金属活动性大于铜,由题意可知,向废液中加入过量的铁屑,铁能与硝酸铜反应生成了铜和硝酸亚铁,过滤时得到的固体a中应含有铁和铜,向滤液中加入氢氧化钠时,硝酸亚铁能与氢氧化钠反应生成了氢氧化亚铁沉淀和硝酸钠,氢氧化亚铁在空气中已被氧化为氢氧化铁;为了除去钡离子,应加入硫酸钠、碳酸钠等.所以:
A、由上述分析可知,固体a是铜、铁,故A错误;
B、由上述分析可知,X可能是Na2SO4、Na2CO3,故B错误
C、由上述分析可知,溶液B中含有的盐有Ba(NO3)2、NaNO3,故C正确;
D、由于铁的量是过量的,若回收到6.4g固体a,则加入的铁屑质量不一定为5.6g.故D错误.
故选:C.
点评 本题考查了物质的分离提纯的方法,难度比较大,熟悉常见金属的回收方法、混合物的分离方法是解答本题的基础知识.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 倡导环保低碳生活 | B. | 大力发展燃煤发电 | ||
| C. | 循环高效利用资源 | D. | 鼓励乘坐公交出行 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 某同学在实验室用6.5g粗锌(假设杂质不参与反应)和稀盐酸制取H2.
某同学在实验室用6.5g粗锌(假设杂质不参与反应)和稀盐酸制取H2.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com