
分析 根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,结合元素守恒进行分析解答.
解答 解:CaH2加入碳酸钠溶液中的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
充分反应后过滤、洗涤、烘干,得到滤渣碳酸钙质量为20g,.
20g碳酸钙中钙元素的质量为20g×$\frac{40}{100}$×100%=8g,结合元素守恒知,含8g钙元素的钙化氢的质量:8g÷($\frac{40}{42}$×100%)≈7.62g,
该样品中氢化钙的质量分数是$\frac{7.62g}{10g}$×100%=76.2%.
答:氢化钙样品中氢化钙的质量分数约为76.2%.
点评 本题有一定难度,考查同学们处理及灵活运用所学知识进行分析问题、解决问题的能力.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:初中化学 来源: 题型:解答题
 如图是某化肥厂在一公共场所的围墙上做的广告:请仔细观察、分析,并回答下列问题:
如图是某化肥厂在一公共场所的围墙上做的广告:请仔细观察、分析,并回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
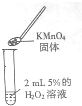 小明和同学用H2O2溶液制取氧气时,错将KMnO4固体当成二氧化锰放入了H2O2溶液中,结果也发现溶液中迅速产生气泡.小明想:放出的气体是氧气吗?高锰酸钾是H2O2分解的催化剂吗?
小明和同学用H2O2溶液制取氧气时,错将KMnO4固体当成二氧化锰放入了H2O2溶液中,结果也发现溶液中迅速产生气泡.小明想:放出的气体是氧气吗?高锰酸钾是H2O2分解的催化剂吗?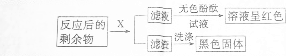
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 盛装固体药品--细口瓶 | B. | 取用碳酸钠粉末--镊子 | ||
| C. | 移取少量液体--滴管 | D. | 少量液体间反应--量筒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com