
��ѧ��ȤС�����÷��ռ������Na2CO3��NaCl��MgCl2��CaCl2�ȣ���Na2CO3��10H2O��
����ȡ���̡�

��������ϡ���Na2CO3+H2O+CO2��2NaHCO3
��2NaHCO3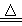 Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
����NaHCO3��Һ�м���BaCl2��Һ���ɷ�����Ӧ��2NaHCO3+BaCl2��BaCO3��+2NaCl+ H2O+CO2��
��̼���Ƶı�����Һ�ڲ�ͬ�¶��������ľ�������ͼ��ʾ��
���������ۡ�
��1��������Ҫ�ɷ�ΪMg��OH��2�� ������Mg��OH��2�Ļ�ѧ����ʽ ��
��2����������ʹ�õIJ��������У��ձ��� �Ͳ�������
��3��ȡ������ҺB������BaCl2��Һ����ֻ�ϣ����۲쵽 ������������ҺB�к�NaHCO3��
��4���ᾧ����ʱ���¶������ �档
��5����ĸҺ������������������·��ѭ��ʹ�ã�ԭ���� ��ѡ����ţ���
�١�ĸҺ������Na2CO3
�ڡ�ĸҺ�����ѭ����NaCl��������
�����ȷ����
��6��ȡ�����ֲ�Ʒ����ˮ�ܽ⣬������ ��ѡ��������ţ���ͬ������ֽ��裬�ټ����� ��������֤�����в���NaCl��
��AgNO3��Һ ��ϡ���� ��ϡ����
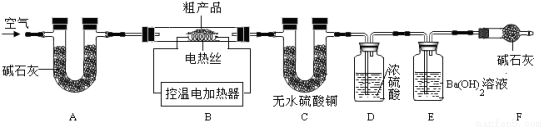
��7����ȤС��ͬѧȡ32.8g����ֲ�Ʒ������ͼ��ʾװ�ã��г�����ʡ�ԣ�����ʵ�飺
��������1��Na2CO3��10H2O������32�棬��ʼ�ֽ�ʧˮ����ּ��ȿ���ȫʧˮ��NaHCO350��ʱ��ʼ�ֽ�270��ʱ��ȫ�ֽ⣻Na2CO3���Ȳ��ֽ⡣
��������2��Ba(OH)2��Һ������CO2��Ba(OH)2+CO2=BaCO3��+H2O
��ʵ��ǰҪ�� ����װ��ֲ�Ʒ��
װ��A�������� ��
�ڴֲ�Ʒ������270�棬�� ����װ�ñ�ż�������֪�ֲ�Ʒ�к�NaHCO3�����C��D������m1��E��������m2����m1��m2 �����������=��������9��22��
ʵ����m2��1.1g���������32.8g�ֲ�Ʒ�к���NaHCO3������Ϊ g��
�۵�������36��ʱ�����B��ʣ�����27.4g�����ʣ������� ���ѧʽ����NaHCO3�Ļ������˿�2�֣�
��1��CaCO3�� 2Na OH+ MgCl2=2NaCl+Mg��OH��2��
��2��©��
��3����������
��4��32
��5����
��6���ۡ���
��7���ټ��װ�õ������� ���տ����еĶ�����̼��ˮ����
��C�б�Ϊ��ɫ��E�в�����ɫ���� �� 4.2 ��Na 2CO3��7H2O
��������
������������������ۡ���1���ռ������������Ȼ�þ��Ӧ������������þ������̼�������Ȼ��Ʒ�Ӧ������̼��Ƴ�������������Ҫ�ɷ�Ϊ������þ��̼��ƣ���2������������Ҫ��������Һ����룬��Ϊ���˲���������Ҫ©������3���Ȼ�����̼�����Ʒ�����Ӧ���£�2NaHCO3+BaCl2��BaCO3��+2NaCl+ H2O+CO2�������������ݺͰ�ɫ����ʱ��֤����ҺB�к�̼�����ƣ���4���ᾧ����ʱ���¶������32��
��5����ĸҺ������������������·��ѭ��ʹ�ã�ԭ���ǡ�ĸҺ�����ѭ����NaCl�������ӣ���ѡ��;�����ȷ�����ȼ����ᣬ��ȥ̼���ƣ�Ȼ�������������Һ�������Ȼ��ƣ����������Ȼ��Ʋ�����ɫ�������Ұ�ɫ�����Ȼ���������ϡ���ᡣ��ʵ��ǰҪ�ȼ��װ�õ������ԣ��ټ���ֲ�Ʒ����ʯ�������տ����е�ˮ�ֺͶ�����̼������������ڴֲ�Ʒ������270��ʱ����ȫ�ֽ⣬����ˮ��������̼��̼���ƣ�������̼��ʹ����ʯ��ˮ����ǣ���ˮ����ͭ��ˮ��Ϊ��ɫ��̼���������ȷֽ����ˮ��̼���ƾ���ֽ�Ҳ�����ˮ��C��D������m1��������ˮ��������E��������m2��̼���������ȷֽ����������̼������2NaHCO3  Na2CO3+H2O+CO2�����м��㣬ˮ�Ͷ�����̼������Ϊ9��:22������m1��m2��9��22��
Na2CO3+H2O+CO2�����м��㣬ˮ�Ͷ�����̼������Ϊ9��:22������m1��m2��9��22��
��������
��̼����������ΪX
2NaHCO3  Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
168 44
X 1.1g
168/44=X/1.1g X=4.2g
�۵�������36��ʱ,̼���������Ȳ���ֽ⣬���ݢ���̼����������Ϊ4.2g��֪���ֲ�Ʒ�к���̼�����ƾ���28.6g����̼��������=28.6g����106/136��100%��=10.6g����������36��ʱ�����B��ʣ�����27.4g��̼�����Ƶ�����Ϊ4.2g����̼���ƾ�������=27.4g-4.2g=23.2g ������ʽΪ��
23.2g ����106/106+18n��100%��=10.6g n=7����ѧʽΪ��Na 2CO3��7H2O
���㣺ʵ�鷽������������ۡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ�����о��꼶3���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͼ������ȷ��ӳ��Ӧ�仯��ϵ����

A��ϡ��10%NaOH��10% H2SO4
B�����������п�ۺ������зֱ������ͬ��ϡ����
C����ˮͨ����һ��ʱ��
D������һ����������ع���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ���꼶��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��������������������������������Һ��ϡ�����ϣ����������в������Ϻ����Һ������Ӧ����
A��CO2 B��AgNO3 C��Cu(OH)2 D��BaCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�곤���г�������ѧ�ھ��꼶��ĩ�ʿ��Ի�ѧ�Ծ��������棩 ���ͣ������
��ش�������ˮ�йص����⡣
��1������ˮ�Ļ�ѧ���ʵ���С������ ��
��2����ȥˮ�в��������ʵIJ����� �� �������м���Ӳˮ����ˮ������ �� ��
��3����������ˮ������Ҫԭ���� ��
��4����ϸ��˿��������ȼ��ʵ��ʱ��ƿ��������ˮ��Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�곤���г�������ѧ�ھ��꼶��ĩ�ʿ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ԫ�����ڱ��е�þԪ�ؼ���ԭ�ӽṹʾ��ͼ��ͼ��ʾ������˵���д������

A��þ���ڽ���Ԫ��
B��þԪ�ص����ԭ������Ϊ12
C��þԭ������ʧȥ����
D����MgO��þԪ�صĻ��ϼ�Ϊ+2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ������ʮ����꼶��ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ������
��1�֣�����������FeC2O4��������ˮ�����Ȼ�ֽ⡣������������Һ�Ͳ������Һ��Ӧ���Ʊ�������������FeC2O4��2H2O����Է�������180����д���Ʋ����������巴Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ������ʮ����꼶��ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
���и�����Һ�����������Լ��Ͳ��ܼ����������
A��NaCl��ϡHCl��NaOH��ʯ�� B��NaOH��NaCl��ϡHCl��FeCl3
C��Na2SO4��K2CO3��BaCl2��ϡHCl D��Na2CO3��ϡH2SO4��ϡHCl��NaNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ������ʮ����꼶��ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ڻ�ѧ�仯����
A�������ܽ� B����ˮ�ɱ� C���������� D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ�����г�����ѧ�ڵ�һ���¿���ѧ���Ծ��������棩 ���ͣ�ѡ����
�����������ڽ������ϵ���
A������ B������ C���ֽ������ D������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com