
| 实验操作 | 实验现象 | 实验结论 |
| 取适量该漂白液放入烧杯中,再放入有颜色的布条 | 该漂白液已完全失效 |
| 实验步骤 | 预期实验现象 | 实验目的或预期结论 |
| 步骤①;取少量该漂白液于试管中,加入 | 产生白色沉淀 | 目的: |
| 步骤②:取上层清液于试管中,加入 | 结论: 猜想 |
| 73 |
| x |
| 44 |
| 4.4g |
| 7.3 |
| 100 |
| 实验操作 | 实验现象 | 实验结论 |
| 取适量该漂白液与烧杯中,放入有色布条 | 布条没有明显变化 | 该漂白液已完全失效 |
| 实验步骤 | 预期实验现象 | 实验目的或预期结论 |
| 步骤①;取少量该漂白液于试管中,加入足量的CaCl2溶液,静置,观察 | 产生白色沉淀 | 目的: 验证并除去Na2CO3 |
| 步骤②:取上层清液于试管中,滴入无色酚酞试液,观察 | 试液变红 | 结论: 猜想Ⅲ成立 |


科目:初中化学 来源: 题型:
| A、蜡烛的燃烧是蜡烛与氧气发生了化学反应 |
| B、蜡烛燃烧生成了水和二氧化碳 |
| C、蜡烛的燃烧是物理变化 |
| D、蜡烛受热熔化是物理变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:
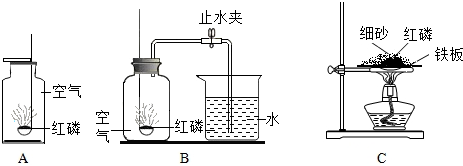
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量该氢氧化钠溶液于试管中,滴加 | 该氢氧化钠溶液已变质 |
| 实验步骤 | 实验现象 | 实验结论 |
| 1取少量该氢氧化钠溶液于试管中 , 2加入足量 3过滤 4在滤液中滴加 | 2有白色沉淀生成 4 | 氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:
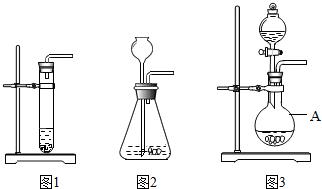 下列三套装置(见如图)都可用于实验室制取CO2.
下列三套装置(见如图)都可用于实验室制取CO2.| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5g | 1.5g |
| 第二次加入5g | 1.0g |
| 第三次加入5g | 0.5g |
| 第四次加入5g | 0.3g |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com