
 海洋是一座巨大的宝库,海水中蕴含着 80 多种元素.氯碱工业就是以海水为原材料来大量制取烧碱和氯气.烧碱和氯气是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.
海洋是一座巨大的宝库,海水中蕴含着 80 多种元素.氯碱工业就是以海水为原材料来大量制取烧碱和氯气.烧碱和氯气是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.分析 (1)根据质量守恒定律和氯碱工业中发生反应的化学方程式为:2NaCl+2H2O=2NaOH+Cl2↑+A,推测A的化学式;
(2)根据溶解度曲线的交点来分析;根据物质的溶解度受温度的影响情况来分析.
解答 解:(1)根据质量守恒定律和氯碱工业中发生反应的化学方程式为:2NaCl+2H2O=2NaOH+Cl2↑+A,反应前有;2Na、2Cl、4H、2O,反应后有:2Na、2H、2Cl、2O,故A中含有两个氢原子,故填:H2;
(2)①P点表示t1℃时,甲乙两物质的溶解度相等.故填:表示t1℃时,甲乙两物质的溶解度相等;
②根据溶解度曲线来分析:甲物质的溶解度随温度升高明显增大,而乙物质溶解度受温度的变化影响小.降温时,甲物质溶解度明显变小,其饱和溶液中会有大量结晶析出,而乙不会,故填:降温结晶;甲物质的溶解度随温度升高明显增大,而乙物质溶解度受温度的变化影响小,降温时,甲物质溶解度明显变小,其饱和溶液中会有大量结晶析出,而乙不会.
点评 主要考查了质量守恒定律、固体溶解度曲线的意义及固体溶解度和温度间的关系,并能利用所学知识来解决实际问题.


科目:初中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③ | C. | ①②⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | KOH、Na2SO4、CuSO4、MgCl2 | B. | K2CO3、BaCl2、Na2SO4、HCl | ||
| C. | Na2SO4、BaCl2、KNO3、NaCl | D. | NaNO3、AgNO3、KNO3、NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 .下列说法错误的是( )
.下列说法错误的是( )| A. | 该粒子属于原子 | B. | 该元素在化合物中常显+2价 | ||
| C. | 该元素的一个离子含有10个电子 | D. | 该粒子在化学反应中容易得到电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CO | CO2 | 通过足量氢氧化钠溶液,用浓硫酸干燥 |
| B | NaCl | 泥沙 | 溶解、过滤、蒸发 |
| C | N2 | O2 | 通过足量的灼热铜闸 |
| D | NaOH溶液 | Na2CO3 | 加适量AgNO3溶液、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 胃酸过多的病人可以服用胃舒平(主要成分是氢氧化铝的药物) | |
| B. | 洗涤剂具有乳化功能,可以洗去衣服上的油污 | |
| C. | 用食盐水可以除去水垢 | |
| D. | 用加热煮沸的方法将硬水软化 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫粉在氧气中燃烧发出明亮的蓝紫色火焰 | |
| B. | 加热碱式碳酸铜观察到固体由绿色变为黑色 | |
| C. | 鸡蛋清溶液中加入几滴浓硝酸出现白色凝固物 | |
| D. | 氢氧化钠溶液中滴加硫酸铜溶液生成蓝色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
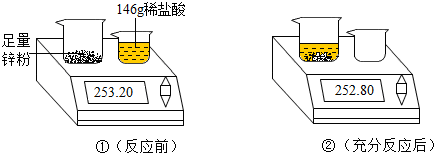
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com