
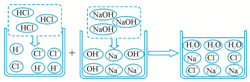
分析 根据复分解反应的实质以及条件进行分析解答即可.
解答 解:盐酸与硝酸银溶液反应实质是银离子与氯离子结合生成氯化银沉淀,故填:Ag++Cl-═AgCl↓;
HNO3溶液与Na2CO3溶液反应实质是氢离子和碳酸根离子结合产生二氧化碳和水,故填:2H++CO32-═H2O+CO2↑;
复分解反应的实质是阴阳离子结合生成沉淀、气体和水的反应,故填:沉淀、气体和水.
A.H+和CO32-结合能生成二氧化碳和水,不能共存;
B.Ba2+和SO42-能结合产生硫酸钡沉淀,不能共存;
C.Cu2+和OH-能结合生成氢氧化铜沉淀,不能共存;、
D.H+、K+、Cl-、SO42-在溶液中能共存;
故填:D.
点评 本题考查的是复分解反应的知识,完成此题,可以依据已有的复分解反应的条件进行.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | PbO | B. | Pb2O3 | C. | Pb3O4 | D. | PbO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mg和MgO | B. | Mg(OH)2和MgO | C. | MgO和MgCO3 | D. | MgCO3和Mg(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H2 | C. | CH4 | D. | CH4O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 木槿花的溶液与酸作用显红色是化学变化 | |
| B. | 能使木槿花的溶液显绿色的一定是碱 | |
| C. | 将氯化钠溶液滴入木槿花的溶液后,溶液仍为紫色 | |
| D. | 木槿花的溶液可用作酸碱指示剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com