
工业生产中利用下列化学反应生产氨气,化学方程式为:
N2+3H2科目:初中化学 来源: 题型:
 2011年3月22日是第十九届“世界水日”.今年世界水日的主题是“城市用水:应对都市化挑战”.南京目前还是地下管网雨污合流.平时,浪费了污水处理设施的处理能力;每逢暴雨,为了尽快泄洪直接排水,又导致秦淮河、玄武湖的水质骤然变差.为此,南京投资183亿元打造雨污分流工程,雨水补充河道,污水进入污水治理厂处理,治水经济集约.
2011年3月22日是第十九届“世界水日”.今年世界水日的主题是“城市用水:应对都市化挑战”.南京目前还是地下管网雨污合流.平时,浪费了污水处理设施的处理能力;每逢暴雨,为了尽快泄洪直接排水,又导致秦淮河、玄武湖的水质骤然变差.为此,南京投资183亿元打造雨污分流工程,雨水补充河道,污水进入污水治理厂处理,治水经济集约.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
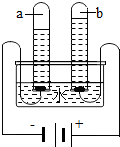
科目:初中化学 来源: 题型:
查看答案和解析>>
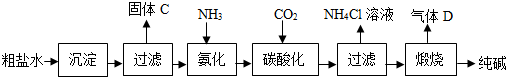
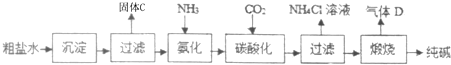
科目:初中化学 来源: 题型:阅读理解
 可知,氮原子最外层电子数目为
可知,氮原子最外层电子数目为查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究
甲醇具有重要意义。
 (1)用CO合成甲醇的反应为:CO(g)+2H2(g)
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)  CH3OH (g)
CH3OH (g)
在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验 测得甲醇的物质的量和温度、时间的关系曲线如右图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为_______。
 ②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。
和CH3OH(g)的浓度随时间变化如右图所示。从反应开始到
平衡,v(H2)=_______ ;该温度下的平衡常数数值K=______。
能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
 ①甲醇蒸汽重整法。主要反应为;CH3OH(g)
①甲醇蒸汽重整法。主要反应为;CH3OH(g)  CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催
化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如右图所示。则当n(O2)/n(CH3OH) =0.25时。CH3OH与O2发生的主要反应方程式为______ 。在制备H2:时最好控制n(O2))/n(CH3OH)=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com