
下列实验设计能够达到实验目的的是
A.在空气中灼烧鉴别黄铜和黄金
B.用品尝的方法鉴别食用盐和工业用盐
C.用硫酸除去氯化钠溶液中的氢氧化钠
D.用酚酞试液检验氢氧化钠溶液是否变质
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
由于自然界中存在碳—氧循环,因此空气的成分基本保持不变。据此回答下列问题:
(1)自然界中吸收CO2的主要途径为__________。
(2)有人认为自然界中CO2越多越好。也有人认为CO2越少越好,最好没有。你认为是否正确________,理由是________________________________________。
(3)为防止大气中CO2的含量不断上升,从节能减排的角度,提出一条合理建议______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
下列说法中正确的是
A. 自来水经过煮沸能得到纯净水
B. 电解水生成氢气和氧气,说明水是由氢气和氧气组成的
| |
 于水的过程中蔗糖分子和水分子都在不断运动
于水的过程中蔗糖分子和水分子都在不断运动 D. 水和过氧化氢的组成元素一样,所以化学性质也一样
查看答案和解析>>
科目:初中化学 来源: 题型:
下表是NaOH和Ca(OH)2的溶解度数据 ,请回答下列问题。
,请回答下列问题。

(1)从表中数据可以获得的信息是____ __(写一条)。
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是_____________,此时溶液的溶质质量分数为 。(保留一位小数)
 (3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答:
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答:
(Ⅰ)步骤②中加入过量Ca(OH)2的目的是____ ;
涉及反应的化学方程式为__ ____。
(Ⅱ)滤液B中的溶质是_______ _________(写化学式);
步骤③所包含的具体操作是加热浓缩、 、过滤。
(Ⅲ)若实验前称得样品的质量为10g,实验后称得“滤渣A”和“NaOH固体”的质量分别是5g和8.7g,则此样品的纯度为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
【实验分析】小科同学根据以上思路 ,设计了如图1的实验装置。
,设计了如图1的实验装置。
 ①实验装置乙中盛放的试剂为 。
①实验装置乙中盛放的试剂为 。
装置丁中碱石灰的作用是 。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
 ②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的
质量分数 (填写“偏高”“偏低”或“不变”).
 ③小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,你
③小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,你
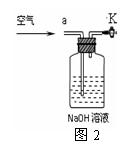
认为他的理由是 ,应该将装置甲中双孔橡
胶塞换成三孔橡胶塞,并增加图2装置,实验结束后缓缓通入一段时间空气,
目的是 ,其中NaOH溶液的作用是 。
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即Na2CO3已完全反应)的方法是: 静置,向上层清液中滴加 溶液,如果没有白色沉淀生成,证明CaCl2过量;
③过滤、操作X、干燥、称量沉淀的质量为10.0g,操作X的名称是 ,如果缺少此操作会造成碳酸钠质量分数 (填写“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为 。(写出计算过程,结果保留至0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
下图是某厂生产纳米碳酸钙的工艺流程。

请回答下 列问题:
列问题:
(1)请完成并配平该工艺中生成CaCO3固体的反应方程式:
CaCl2+_________+CO2=CaCO3↓+__________+H2O
(2)若在实验室中进行该实验,操作l的名称是___________,使用到的非玻璃实验用品有_________、________。
(3)上述过程制得的碳酸钙粗品表面可能含有的可溶性杂质有___________(写一种化学式即可)。操作2为:_________、检验和干燥,检验操作中选用的试剂为____________(选择序号)。 ①NH4Cl溶液 ②AgNO3溶液 ③CaCl2溶 液 ④Ba(NO3)2溶液
液 ④Ba(NO3)2溶液
(4)上述流程中的副产品可用作__________________________________。(写一种用途)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com