
【题目】学校化学兴趣小组的同学知道二氧化锰能作过氧化氢(H2O2)分解的催化剂后,想再探究其他一些物质如氧化铜是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白。
【提出问题】氧化铜能不能作过氧化氢分解的催化剂呢?
【作出猜想】氧化铜能作过氧化氢分解的催化剂。
【实验验证】
实验步骤 | 实验现象 | 实验结论 | |
实验一 | ① | 有少量气泡 | 常温下过氧化氢溶液分解速率很慢。 |
实验二 | 在装有过氧化氢溶液的试管中加入少量氧化铜,然后将带火星的木条伸入试管中。 | 产生大量的气泡 | ② |
【得出结论】氧化铜能加快过氧化氢的分解速率,故氧化铜能作过氧化氢分解的催化剂。
【反思提高】经过讨论,有的同学认为只有上述两个证据,不能证明氧化铜能作过氧化氢分解的催化剂,还要补充一个探究实验:
实验三:
[实验目的]探究。
[实验步骤]①准确称量氧化铜(少量)的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤, , 称量;④对比反应前后氧化铜的质量。
[交流讨论]如果氧化铜在反应前后质量不变,则说明氧化铜可以作过氧化氢分解的催化剂。
【提出新的问题】小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验探究。
【答案】将带火星的木条伸入装有过氧化氢溶液的试管中;在常温下氧化铜能加快过氧化氢的分解速率;在反应前后氧化铜的质量是否发生变化;干燥;在反应前后氧化铜的化学性质是否发生变化
【解析】解:【实验验证】实验过程如下表所示:

[实验目的]探究(3)氧化铜在反应前后的质量是否改变.
故填:氧化铜在反应前后的质量是否改变.
[实验步骤]①准确称量氧化铜(少量)的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,(4)干燥,称量;④对比反应前后氧化铜的质量.
故填:干燥.
【提出新的问题】小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:探究(5):氧化铜在反应前后的化学性质是否改变;
向探究(3)反应结束后的试管中加入适量的过氧化氢溶液,把带火星的木条伸入试管中;
产生大量的气泡,木条复燃;
氧化铜在反应前后化学性质不变,说明氧化铜可以作过氧化氢分解的催化剂.
故填:氧化铜在反应前后的化学性质是否改变;
向探究(3)反应结束后的试管中加入适量的过氧化氢溶液,把带火星的木条伸入试管中;
产生大量的气泡,木条复燃;
氧化铜在反应前后化学性质不变,说明氧化铜可以作过氧化氢分解的催化剂.
①做对比实验时必须控制变量,只有一个条件不同,才知道该条件对实验是否有影响。②根据现象得结论,产生大量的气泡,木条复燃,说明反应速率加快。催化剂在反应前后质量不变,故应该探究氧化铜的质量是否发生改变。过滤洗涤后氧化铜表面占有水分,故应该进行干燥。催化剂在化学反应前后化学性质不变,故应该再探究氧化铜的化学性质是否发生改变。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:初中化学 来源: 题型:
【题目】物质的化学式与名称对应正确的是
A. 氯化氨:NH4Cl B. 氢氧化铁:Fe(OH)2
C. 硝酸钙:Ca(NO3)2 D. 碳酸钠:NaCO3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知某氧原子的相对原子质量为16,某硫原子的相对原子质量为32。如果该氧原子的质量为m,则该硫原子质量为
A.32m B. 2m C. m D. 不能确定
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】区别下列各组物质所用的试剂或方法中,不正确的是
A. 白银和铂金----稀盐酸 B. 硬水和软水----肥皂水
C. 氮气和氧气----燃着的木条 D. 氧气和二氧化碳----澄清石灰水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】3月22日是“世界水日”,下列关于水的说法正确的是:
A. 生活中用肥皂水鉴别硬水和软水,利用活性炭的吸附性来降低水的硬度
B. 自然界水的循环过程中实现了水的自身净化
C. 自来水厂净水的过程有静置沉淀、过滤、吸附、蒸馏
D. 从电解水得到H2和O2,可知水是由氢分子和氧分子组成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列物质的分类正确的是
A. 清洁能源——太阳能、风能、煤 B. 单质——C60、He、水银
C. 金属材料——青铜、铁、氧化铝 D. 酸——醋酸、盐酸、硫酸钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列鉴别物质的方法中,切实可行的是 ( )
A. 用水鉴别氢氧化钠固体和碳酸钠固体
B. 用燃着的木条鉴别二氧化碳和氮气
C. 用蒸馏水鉴别氧化铜和二氧化锰
D. 用碳酸钠溶液鉴别氢氧化钙和氯化钙溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某腐蚀印刷电路板的废液中含有CuCl2和FeCl2 , 为了分析该废液的组成,取1000g废液,设计如下实验方案进行探究: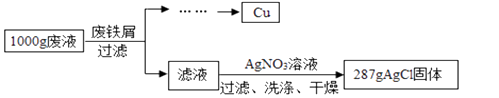
实验过程中加入废铁屑的质量、析出Cu的质量的数据记录如下表:
废铁屑的质量/g | 20 | 40 | 60 | 80 |
析出Cu的质量/g | 12.8 | 25.6 | 32 | 32 |
(注:废铁屑中的杂质不溶于废液也不与废液反应,不考虑过滤中的损失。)
(1)1000g废液与足量废铁屑完全反应,析出Cu的质量为 g。
(2)废铁屑中单质Fe的质量分数为。
(3)计算1000g废液中CuCl2的质量分数。(写出计算过程,结果保留小数点后一位)
(4)1000g废液中FeCl2的质量分数为。(结果保留小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com