
【题目】用化学符号填空:
(1)-2价的氧元素____________;(2)镁离子____________;
(3)硫酸____________ ; (4)2个二氧化硫分子______。
科目:初中化学 来源: 题型:
【题目】多角度认识物质的变化,有助于我们更好地理解化学知识。
(1)从微观角度
(下图为某化学反应的微观示意图,据图回答下列问题。)
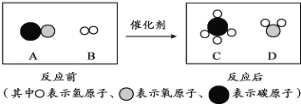
①微观上看,该化学变化中发生根本改变的微粒是____________(填“原子”或“分子”)。
②参加反应的A与B两种物质的分子个数比为______________。
(2)从反应类型角度(一种物质可通过不同的反应类型生成,以水为例。)
①能与氧气化合生成水的物质是___________(填一种物质化学式)。
②分解生成水的化学方程式是_________________。
③在加热条件下,氢气与氧化铜能发生置换反应,生成水和________(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3)。如图是超市销售的一种加碘盐标签的部分文字说明,请回答下列问题:

(1)该碘酸钾由_____种元素组成。它的相对分子质量为_____,碘酸钾中钾、碘、氧、三种元素比为_____。
(2)碘酸钾中碘元素的质量分数为_____(结果保留到0.1%)
(3)每袋该食盐中碘酸钾的质量为多少毫克?_____(结果保留到0.1mg)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有镁、铝两种金属分别与稀盐酸充分反应,生成相同质量氢气。某同学推测的情况如下:①足量的稀盐酸与等质量的镁、铝分别发生反应;②足量的稀盐酸与质量比为4∶3的镁、铝分别发生反应;③足量的稀盐酸与质量比为8∶9的镁、铝分别发生反应;④等质量、等溶质质量分数的稀盐酸与过量的镁、铝分别发生反应,其中正确的推测是( )
A. ①② B. ①④ C. ②④ D. ③④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知M、N在一定条件下,能发生反应:M+2N=P+2Q,则下列说法中不正确的是( )
A. M、N、P、Q可能含有同一种元素
B. 若P、Q都是化合物,则该反应一定是复分解反应
C. 若M、N、P、Q都是由分子构成的物质,则该反应前后分子的数目一定不变
D. 若16g M和64g N能恰好完全反应,则M、N的相对分子质量之比为1:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了消除人体碘缺乏病,我国政府规定食用盐是加碘食盐,简称碘盐。所谓碘盐就是在食盐中加入一定量的碘酸钾(KIO3)。计算(计算结果精确到0.1)
(1)KIO3的相对分子质量为__________________,
(2)碘酸钾中各元素的质量比K:I:O = __________________,
(3)42.8g碘酸钾中含碘元素的质量为______(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图中A、B、甲、乙、丙均是初中化学常见的物质,其中甲、乙、丙属于同种类别的化合物;甲、丙和足量的A反应能生成相同的生成物。A、B均含两种元素,其混合物有挥发性,挥发出的气体能使湿润的蓝色石蕊试纸变红。丙的相对分子质量为106,被广泛应用于玻璃、纺织等工业。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在相应的转化关系,部分反应物、生成物及反应条件已略去。下列推断错误的是( )
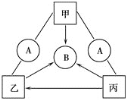
A. 甲、乙、丙均属于盐类
B. 丙和A发生的反应属于复分解反应
C. 除去乙中混有的丙可通过溶解、过滤、洗涤、干燥来达到目的
D. 可用无色酚酞溶液一次性鉴别甲、丙、A的溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学学科的特点,汽车尾气排放的有毒气体可在“催化转化器”中转化为无污染的气体。如图为微观反应示意图,请回答:
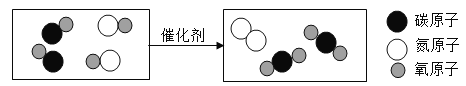
(1)该微观反应过程中出现了_____种氧化物
(2)该反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用高温煅烧石灰石制备CO2,某探究小组欲探究煅烧后的固体残留物成分
[资料] ①CaO +2HCl = CaCl2+ H2O ②CaCl2溶液呈中性
(1)高温煅烧石灰石的方程式为___________________,根据化学方程式进行猜想:
猜想一:只有CaO,猜想二:有 CaO和________________
[实验验证]
(2)两位同学设计实验方案如下表
甲同学 方案一 | 乙同学 方案二 | |
实验步骤现象 |
|
|
①据甲同学方案一中现象,可判断剩余固体中一定含有_______,用方程式解释__________。
②乙同学认为猜想二一定正确,该同学的方案是否合理?_______,理由是______________。
③丙同学认为结合方案一和方案二可以判定猜想二成立,该观点____(填“正确”或“不正确”)
[讨论与反思]小组同学认为,导致残余固体中不止含有一种物质的原因可能是石灰石的状态导致的,为此他们模拟工业操作,在实验室高温煅烧石灰石,相关记录如下表
石灰石(不含杂质) | 状态 | 温度 | 最终收集到CO2的质量 | |
实验1 | 2g | 块状 | 800℃ | 0.748g |
实验2 | 未知 | 粉末状 | 800℃ | 0.876g |
(3)上表中实验1中的产率为___________(产率=实际产物质量÷理论产物质量×100%),为了达成实验目的,实验2中未知质量应该是__________g,
[反思总结]
(4)从表中数据可知,高温煅烧石灰石最好选择_______状态反应更充分,理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com