
分析 本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
解答 解:①3个铝离子就是在铝离子的前面加上数字3,故填:3Al3+;
②氢气的化学式为H2,故填:H2;
③硫酸根离子的符号为SO42-,故填:SO42-;
④地壳中含量最多的元素和最多的金属元素组成的化合物是氧化铝,故填:Al2O3.
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 气体 | 相对分子质量 | 标况下密度(g/L) | 收集方法[] |
| 空气 | 29 | 1.293 | 排水集气法 |
| 氧气 | 32 | 1.429 | 向上排空气法 |
| 二氧化碳 | 44 | 1.964 | 向上排空气法 |
| 氢气 | 2 | 0.089 | 向下排空气法 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 反应前 | 反应后 | ||
| 实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 150 g | 12 g | 157.6 g | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
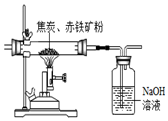 为了测定某赤铁矿中氧化铁的质量分数,化学兴趣小组的同学设计了两种实验方案(假设该赤铁矿中的杂质既不溶于水,也不发生反应).
为了测定某赤铁矿中氧化铁的质量分数,化学兴趣小组的同学设计了两种实验方案(假设该赤铁矿中的杂质既不溶于水,也不发生反应).查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 亚硝酸盐含量(mg/kg) | 封坛前 | 第4天 | 第8天 | 第12天 | 第16天 |
| 1号坛 | 0.15 | 0.6 | 0.2 | 0.1 | 0.1 |
| 2号坛 | 0.15 | 0.2 | 0.1 | 0.05 | 0.05 |
| 3号坛 | 0.15 | 0.7 | 0.6 | 0.2 | 0.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源:江苏省2017届九年级中考模拟考试化学试卷 题型:选择填充题
锗是重要的半导体材料。在元素周期表中,锗元素的信息如图所示,对图中信息解释不正确的是

A. 原子序数为32 B. 元素名称为锗
C. 元素符号为Ge D. 相对原子质量为32
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com