


���� ���ݸ�����ת����ϵ��Ӧ�Ĺ��̷���ÿ����Ӧ�����⣬����ֱ�ӷ���ÿ�����⣬�Ӹ�������Ϣ���Ҷ�Ӧ����Ϣ��
��� �⣺
���Ʊ�Fe2O3
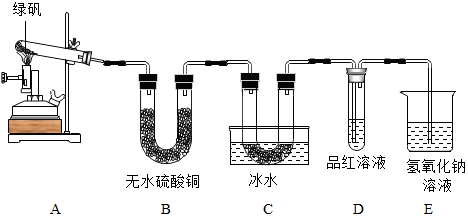
����ʵ�鱾�����Ʊ��������ģ������Թ���ʣ�����Ӧ������������Ϊ��ɫ���ʣ�ʵ������з��֣�A���� ��ɫ�������ɣ�B����ˮ����ͭ������˵����ˮ���ɣ�C��U�ι�������ɫ���壨SO3��������D��Ʒ����Һ��ɫ��˵���ж����������ɣ����Է�Ӧ��Ϊ�̷��������Ǹ��£�������Ϊ��������ˮ������������������Ӧ�Ļ�ѧ����ʽΪ 2FeSO4•7H2O$\frac{\underline{\;����\;}}{\;}$Fe2O3+SO2��+SO3��+7H2O���������������ж��������Ҹ�����Ϣ��ʾ��3����SO2����ɫ����Ϣ�Գ�ζ���ж����壬��ʹƷ����Һ��ɫ��������Ҫ����β����װ��E�������������ж��Ķ������������β���������������ɣ���
�̷����·ֽ�Ļ�ѧ����ʽΪ 2FeSO4•7H2O$\frac{\underline{\;����\;}}{\;}$Fe2O3+SO2��+SO3��+7H2O����
II��
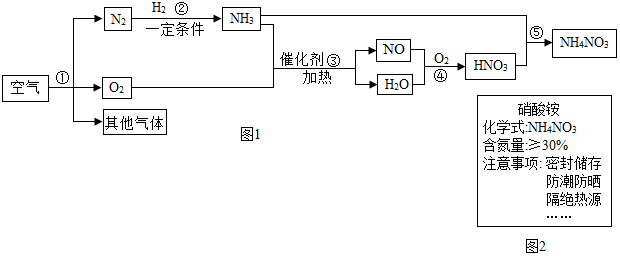
�ɳ���M���Fe3O4�Ĺ����з����ķ�ӦΪ Fe��OH��2+2Fe��OH��3�TFe3O4+4H2O�����ơ�һ������������Ŀ���ǿ���Fe��OH��3��ת���ʣ�
Fe��OH��2+2Fe��OH��3�TFe3O4+4H2O��
90 214
����������Ϊ90��214ʱǡ���������������������Գ���M��Fe��OH��2 ��Fe��OH��3�����������Ϊ 90��214��
��1������ƷP�� Na2SO4������ҺN��øø���Ʒ��������Ŀ�����˿�ʼ�ͽ�β�IJ�������ʼ����Ϊ����Ũ�������Ժ���Ӧ������ȴ�ᾧ���������ܵõ�����������˵õ����壬Ȼ������ô��ᾧˮ�Ĺ���ʧȥ�ᾧˮ�����Բ���˳����b��c��a��d��
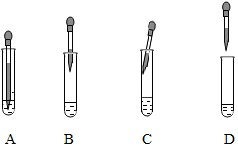
��2���ý�ͷ�ιܼ���е�NaOH��Һ������O2��ʱ����ͷ�ιܵ�ʹ�ù���Ϊ���ա���ֱ�������룬���Խ�ͷ�ιܵ���ȷʹ�÷���Ϊ D��
III��
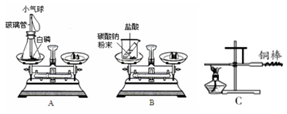
��1������1�������Թ��������������������Һ���룬����Ϊ���ˣ�NH4HCO3��FeSO4��Һ��Ӧ���ɶ�����̼��ˮ��̼������������泥���Ӧ�Ļ�ѧ����ʽΪ 2NH4HCO3+FeSO4=CO2��+H2O+FeCO3��+��NH4��2SO4��
��2������14.06g�ֻ�ԭ���ۣ�����ֻ�ԭ���������ʽ�������FexC��������������ȫ��Ӧ���õ�0.22g CO2���ɵö�Ӧ��̼Ԫ�ص�����Ϊ0.22g��$\frac{12}{12+16��2}$��100%=0.06g������ͬ�����Ĵֻ�ԭ����������ϡ���ᷴӦ���õ�0.48gH2��FexC��ϡ���ᷴӦ������H2����
�赥����������Ϊx��
Fe+H2SO4=FeSO4+H2��
56 2
x 0.48g
$\frac{56}{2}$=$\frac{x}{0.48g}$
x=13.44g
��FexC����Ԫ�ص�����Ϊ14.06g-13.44g-0.06g=0.56g
��FexC����ԭ�Ӻ�̼ԭ�Ӹ�����Ϊ$\frac{0.56g}{56}$��$\frac{0.06g}{12}$=2��1
������FexC ��ѧʽΪFe2C��
�ʴ�Ϊ��
���Ʊ�Fe2O3
�죻�����ж��Ķ������������β���������������ɣ���2FeSO4•7H2O$\frac{\underline{\;����\;}}{\;}$Fe2O3+SO2��+SO3��+7H2O����
II���Ʊ�Fe3O4
90��214��
��1��c��a��
��2��D��
III���Ʊ���ԭ����
��1�����ˣ� 2NH4HCO3+FeSO4=CO2��+H2O+FeCO3��+��NH4��2SO4��
��2������14.06g�ֻ�ԭ���ۣ�����ֻ�ԭ���������ʽ�������FexC��������������ȫ��Ӧ���õ�0.22g CO2���ɵö�Ӧ��̼Ԫ�ص�����Ϊ0.22g��$\frac{12}{12+16��2}$��100%=0.06g������ͬ�����Ĵֻ�ԭ����������ϡ���ᷴӦ���õ�0.48gH2��FexC��ϡ���ᷴӦ������H2����
�赥����������Ϊx��
Fe+H2SO4=FeSO4+H2��
56 2
x 0.48g
$\frac{56}{2}$=$\frac{x}{0.48g}$
x=13.44g
��FexC����Ԫ�ص�����Ϊ14.06g-13.44g-0.06g=0.56g
��FexC����ԭ�Ӻ�̼ԭ�Ӹ�����Ϊ$\frac{0.56g}{56}$��$\frac{0.06g}{12}$=2��1
������FexC ��ѧʽΪFe2C��
���� ��ͼ�����л�ý����Ŀ�������Ϣ�������ڽ����Ŀʱ�ȿ�����������ʲô��Ȼ���������ȥ��������ͼ����ȥѰ�ҽ�����õ���Ϣ�������������Ϣ������Ч�ԣ���������ʵ�����븴�ӵ�ת��ͼ��ȣ���ʵ�ܼܻ��������߿���˵ת��ͼ�ṩ�����龳���������֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
| ʵ����� | 1 | 2 | 3 |
| ϡ����������g�� | 50 | 50 | 100 |
| ��Ʒ������g�� | 20 | 30 | 20 |
| ʣ������������g�� | 63.4 | 73.4 | 113.4 |
| ���������������g�� | 6.6 | 6.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ڿ�����ȼ�ղ���������ɫ���� | |
| B�� | ϸ��˿�ڿ����о���ȼ�գ��������䣬���ɺ�ɫ���� | |
| C�� | þ������ϡ�����У���Ӧ����Һ�¶����� | |
| D�� | ���ˮʵ���У�����������������ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ��̽����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ��̽����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com