
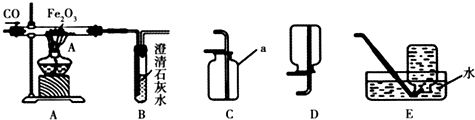
分析 (1)根据一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,二氧化碳能使澄清的石灰水变浑浊,进行分析解答.
(2)根据一氧化碳有毒,会污染环境,进行分析解答.
(3)根据可燃性气体不纯加热可能会发生爆炸,进行分析解答.
解答 解:(1)一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,二氧化碳能使澄清的石灰水变浑浊,实验进行一段时间后,玻璃管A、B中出现的现象是红棕色粉末逐渐变黑,澄清的石灰水变浑浊;A中的化学反应方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)一氧化碳有毒,直接排放到空气中会污染环境,一氧化碳难溶于水,可用排水法收集,B装置后边应连接的装置是E.
(3)CO具有可燃性,与玻璃管中的空气混合受热会发生爆炸,因此应先通CO排尽玻璃管中的空气,然后再点燃加热氧化铁的酒精灯,故实验开始时应先通CO再加热.
故答案为:(1)红棕色粉末逐渐变黑;澄清的石灰水变浑浊;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;(2)E;(3)排尽玻璃管中的空气,防止发生爆炸;
点评 本题难度不大,掌握一氧化碳的化学性质(可燃性、还原性等)、还原氧化铁的实验现象等并能灵活运用是正确解答本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
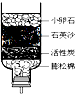 水是生命之源,生活中净化水的方法很多.
水是生命之源,生活中净化水的方法很多.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 稀有气体、硫酸铵、胆矾 | B. | 金刚石、石灰石、铁矿石 | ||
| C. | 天然气、碱式碳酸铜、液氧 | D. | 石墨、熟石灰、碱石灰 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 因为H2O和H2O2的组成元素相同,所以它们的化学性质相同 | |
| B. | 因为酚酞试液遇碱变红色,所以能使酚酞变红色的一定是碱 | |
| C. | 因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成中一定含有C、H和O | |
| D. | 有化合价升降的反应是氧化还原反应,所以复分解反应一定不是氧化还原反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| t/℃ | NaOH | Na2CO3 | NaCl |
| 0 | 42 | 7.1 | 35.7 |
| 10 | 51 | 12.2 | 35.8 |
| 20 | 109 | 21.8 | 36.0 |
| 30 | 119 | 39.7 | 36.3 |
| NaOH | Na2CO3 | NaCl |
| 17.3 | <0.01 | 0.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
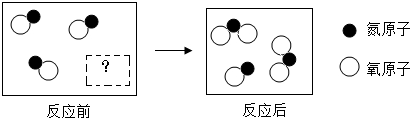
| A. | 反应前虚框中的微粒 为 为 | |
| B. | 该反应过程中氮元素的化合价发生了改变 | |
| C. | 反应前后分子和原子的种类不变 | |
| D. | 该反应过程中参加反应的和生成的各分子个数比可以为2:1:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
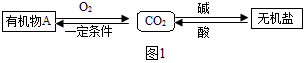
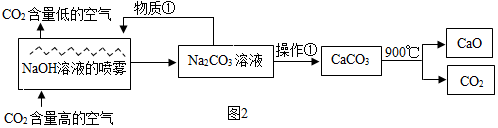
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com