
分析 (1)根据过氧化氢在二氧化锰的催化作用下分解生成水和氧气,然后结合题中的数据进行解答;
(2)根据溶液稀释前后,溶质质量不变进行分析.
解答 解:(1)设需要30%的过氧化氢溶液的质量为x
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
x×30% 16g
$\frac{68}{x×30%}$=$\frac{32}{16g}$
x=113.3g
(2)设需要30%的过氧化氢溶液的质量为y.
200g×3%=y×30%
y=20g
水的质量为:200g-20g=180g.
答:(1)需要30%的过氧化氢溶液的质量为113.3g.
(2)需要30%的过氧化氢溶液的质量为20g,水的质量为180g.
点评 本题主要考查元素质量比的计算,有关溶质质量分数的简单计算以及元素的质量分数计算.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
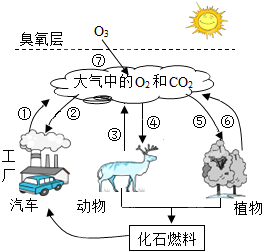 如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图,回答下列问题:
如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | 硫酸溶液的浓度 (均取20mL) | 锌的形状 (均取1g) | 气体的体积(mL) (均收集3分钟) |
| A | 20% | 锌粒 | 31.7 |
| B | 20% | 锌片 | 50.9 |
| C | 30% | 锌粒 | 61.7 |
| D | 30% | 锌片 | 79.9 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④ | C. | ③④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
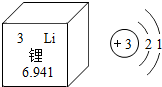 有“锂”走遍天下.锂电池广泛用于通信、电动车等行业,如图是锂的原子结构示意图和元素周期表中锂元素的部分信息,由此判断,锂原子在化学反应中易失去(选填“得到”或“失去”)电子,写出锂离子的符号Li+,氧化锂的化学式Li2O,氢氧化锂与盐酸反应是化学方程式LiOH+HCl═LiCl+H2O.
有“锂”走遍天下.锂电池广泛用于通信、电动车等行业,如图是锂的原子结构示意图和元素周期表中锂元素的部分信息,由此判断,锂原子在化学反应中易失去(选填“得到”或“失去”)电子,写出锂离子的符号Li+,氧化锂的化学式Li2O,氢氧化锂与盐酸反应是化学方程式LiOH+HCl═LiCl+H2O.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某同学家的下水管道堵塞了,于是他买了一瓶“管道疏通剂”(部分说明如图).疏通剂是利用铝与氢氧化钠溶液反应时放出大量的热,以加快氢氧化钠与毛发等淤积物的作用,反应的原理为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.使用一包该疏通剂,当铝与氢氧化钠溶液反应后,溶液中剩余氢氧化钠的质量是120克,请说明剩余氢氧化钠的用途和原理:中和酸性废水,NaOH+HCl=NaCl+H2O.
某同学家的下水管道堵塞了,于是他买了一瓶“管道疏通剂”(部分说明如图).疏通剂是利用铝与氢氧化钠溶液反应时放出大量的热,以加快氢氧化钠与毛发等淤积物的作用,反应的原理为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.使用一包该疏通剂,当铝与氢氧化钠溶液反应后,溶液中剩余氢氧化钠的质量是120克,请说明剩余氢氧化钠的用途和原理:中和酸性废水,NaOH+HCl=NaCl+H2O.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 化学与生活息息相关,可以帮助人类认识、改造世界.
化学与生活息息相关,可以帮助人类认识、改造世界.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 生活离不开水,水既普通又宝贵.
生活离不开水,水既普通又宝贵.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com