
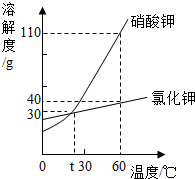
 如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )
如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )| A. | 硝酸钾的溶解度一定大于氯化钾的溶解度 | |
| B. | t℃时,硝酸钾溶液的浓度一定等于氯化钾溶液的浓度 | |
| C. | 把60℃时硝酸钾溶液降温至30℃,一定有硝酸钾晶体析出 | |
| D. | 60℃时,把50 g上述物质分别加入到50 g水中,充分溶解得到硝酸钾溶液的质量一定大于氯化钾溶液的质量 |
分析 A、比较溶解度大小须确定温度;
B、不知溶液中溶质、溶剂质量多少,无法判断溶质的质量 分数大小;
C、不知溶液是否饱和,无法判断降温是否析出晶体;
D、据该 温度下硝酸钾和氯化钾的溶解度分析解答.
解答 解:A、比较溶解度大小须确定温度,故错误;
B、不知溶液中溶质、溶剂质量多少,无法判断溶质的质量 分数大小,故错误;
C、不知溶液是否饱和,无法判断降温是否析出晶体,若饱和则一定析出硝酸钾晶体,故错误;
D、60℃时硝酸钾和氯化钾的溶解度分别是110g、40g,即100g水中最多溶解溶质的质量分别是110g、40g,所以把50 g上述物质分别加入到50 g水中,硝酸钾可全部溶解,氯化钾最多溶解20g,故充分溶解得到硝酸钾溶液的质量一定大于氯化钾溶液的质量,正确;
故选:D.
点评 明确溶解度概念、溶质质量分数、和结晶的方法等知识,才能结合题意灵活解答,要注意细心分析.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加氯化钙溶液(或稀盐酸). | 产生白色沉淀(或有气泡冒出) | 该溶液是碳酸钠溶液. 有关反应的化学方程式为: CaCl2+Na2CO3=CaCO3↓+2NaCl(或Na2CO3+2HCl=2NaCl+H2O+CO2↑). |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加该物质 | 产生白色沉淀 | 该溶液是碳酸钠溶液.有关反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
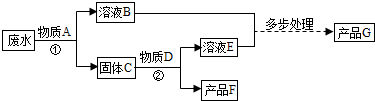 某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品,过程如图所示(废水中的其他物质不参与反应):
某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品,过程如图所示(废水中的其他物质不参与反应):查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.
物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.| 物质 | A | B |
| 滴加的物质 | 稀盐酸 | 稀盐酸 |
| 现象 | 生成浅绿色溶液和一种可燃性气体 | 生成黄色溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
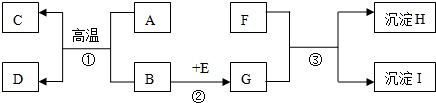
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只含碳、氢元素 | B. | 含有碳、氢、氧三种元素 | ||
| C. | 含有碳、氢元素,可能含有氧元素 | D. | 碳、氢原子个数比为3:4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 | |
| 方案1 | 取样品少量于试管中,加入适量水,震荡,样品全部溶于水,向其中加入无色酚酞溶液 | 溶液变成 红色 | 白色物质 为Na2O |
| 方案2 | 步骤一:取样品少量于试管中,加入适量水,震荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 有白色沉淀生成 | 白色物质 Na2CO3 |
| 步骤二:过滤,取少量滤液于试管中,滴加几滴酚酞试液 | 无色酚酞试液不变色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
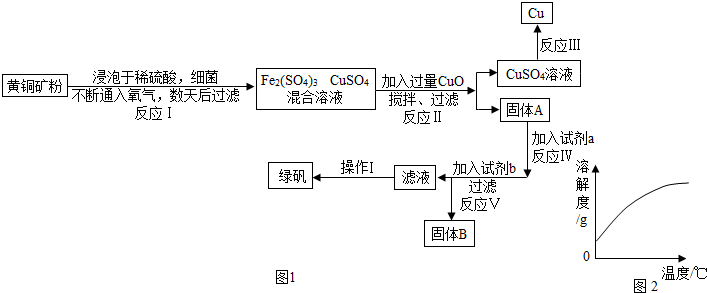
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com