
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
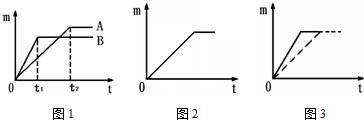
 (2011?呼和浩特)将相同体积,相同溶质质量分教的稀盐酸,分别加入到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中(金属完全反应〕,生成H2的质量与反应时间的关系如下图所示.下列说法中正确的是( )
(2011?呼和浩特)将相同体积,相同溶质质量分教的稀盐酸,分别加入到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中(金属完全反应〕,生成H2的质量与反应时间的关系如下图所示.下列说法中正确的是( )查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品的质量/g | 166.5 | 166.3 | 166.1 | 166.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:
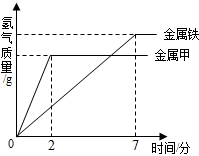 金属活动性顺序在工农业生产和科学研究中有重要应用.请回答下列问题:
金属活动性顺序在工农业生产和科学研究中有重要应用.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
26.(6分)用下列仪器和试剂验证影响金属与盐酸反应速率的因素:烧杯、试管夹、酒精灯、药匙、量筒、天平。锌片、铁片、镁片。5%盐酸、20%盐酸。
(一)不同金属与酸反应的快慢不同
取质量相等的上述两种金属,分别放入溶质质量分数相同的足量稀盐酸中,
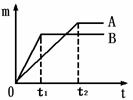
生成氢气的质量(m)与反应时间(t)的关系曲线如图1所示。
![]()
(1)金属活动性顺序表(填元素符号)
K、Ca、Na、 、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
(2)线B对应的金属为 。
(3)线A对应的金属与稀盐酸反应的化学方程式 。
(二)金属与不同质量分数的盐酸反应的快慢不同
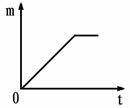
取质量相等的锌片,分别放入5%、20%的足量稀盐酸中。
生成氢气的质量为m,反应时间为t。5%的盐酸与锌片反应m与t的关系曲线如图2所示。请在该图上补画出20%的盐酸与锌片反应m与 t的关系曲线。
实验表明,盐酸质量分数越大,与金属反应的速率越快。
![]()
(三)温度对金属与盐酸反应速率也有影响
取两个烧杯,分别加入等质量的 (“同种”、 “不同种”)金属,再分别加入足量的质量分数 (“相同”、 “不相同”)的稀盐酸……实验表明,温度越高,盐酸与金属反应的速率越快。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com