
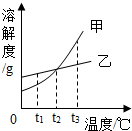
 根据如图的溶解度曲线,判断下列说法中不正确的是( )
根据如图的溶解度曲线,判断下列说法中不正确的是( )| A. | t1℃时,甲物质的溶解度小于乙物质的溶解度 | |
| B. | t2℃时,甲、乙两物质的饱和溶液中含甲、乙两物质的质量相等 | |
| C. | 将t3℃的甲、乙两物质的饱和溶液降温至t2℃时,都会析出晶体 | |
| D. | 当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲 |
分析 A、根据溶解度曲线即可知道t1℃时甲和乙的溶解度大小;
B、根据溶解度的知识进行分析解答;
C、根据溶解度曲线的变化趋势解答;
D、根据溶解度曲线的变化趋势确定析出晶体的方法.
解答 解:A、t1℃时,甲物质的溶解度小于乙物质的溶解度,正确;
B、t2℃时,等质量的甲、乙两物质的饱和溶液中含甲、乙两物质的质量相等,错误;
C、甲和乙的溶解度都随温度的升高而增大,故将t3℃的甲、乙两物质的饱和溶液降温至t2℃时,都会析出晶体,正确;
D、甲的溶解度受温度影响变化大,故当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲,正确;
故选B.
点评 解答本题的关键是知道溶解度曲线表示的意义,交点表示的意义,物质从溶液中结晶析出的方法等知识,考查了学生分析、解决问题的能力.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:初中化学 来源: 题型:选择题
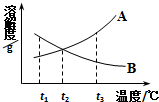 A、B两种物质的溶解度曲线如下图所示.t3℃时,将A、B分别溶于100g水中,各自配成饱和溶液,然后降温.试根据溶解度曲线判断,下列说法正确的是( )
A、B两种物质的溶解度曲线如下图所示.t3℃时,将A、B分别溶于100g水中,各自配成饱和溶液,然后降温.试根据溶解度曲线判断,下列说法正确的是( )| A. | t3℃时,两种饱和溶液中溶质的质量分数相等 | |
| B. | 降至t2℃时,A物质的溶液仍是饱和溶液 | |
| C. | 降至t1℃时,B物质的溶液里溶质的质量分数变小 | |
| D. | 降至t1℃时,两种溶液的质量均不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
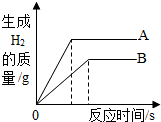 将质量相等的A、B两种金属,同时分别放入两份质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,写出能从中得到的正确结论.(已知:A、B的生成物中均为+2价)
将质量相等的A、B两种金属,同时分别放入两份质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,写出能从中得到的正确结论.(已知:A、B的生成物中均为+2价)查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
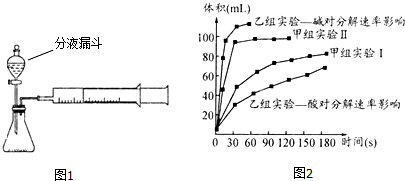
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究浓度对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.
人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com