
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:初中化学 来源:2012届江苏省无锡市江南中学九年级中考模拟(二)化学试卷(带解析) 题型:探究题
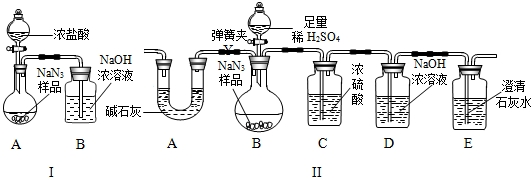
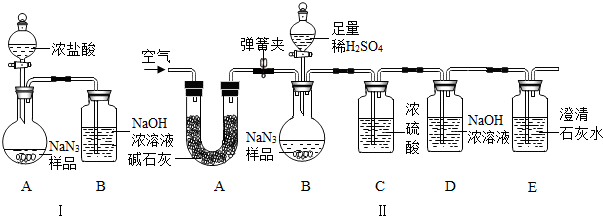
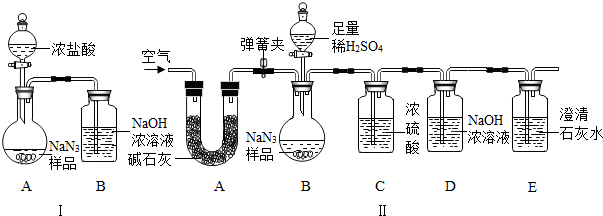
(10分)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。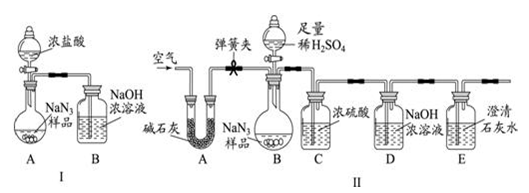
【查阅资料】
①NaN3受撞击会生成Na、N2.
②NaN3遇盐酸、H2SO4溶液无气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和氨气(NH3).
【问题探究】
⑴汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式:
① 。
⑵工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示):
② 。
⑶为测定某工业级NaN3样品中含有Na2CO3的质量分数,化学小组同学设计了如下实验
装置。
①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是 ③ 。
②小刚同学在大家讨论的基础上,设计了装置II.请分析:装置II中A的作用 ④;若无装置C,对测定结果造成的影响是 ⑤ (填“偏大”、“偏小”或“无影响”);
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D.
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
其正确顺序为 ⑥ (填字母序号,可重复).
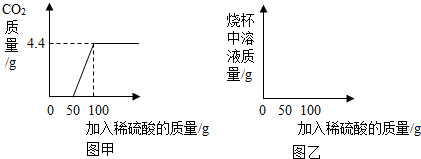
⑷该小组对某一工业级NaN3样品进行检测。取100克该样品于烧杯中,加水将其溶解,然后逐滴加入一定溶质质量分数的稀硫酸并不断振荡。
首先发生的反应是:2Na2CO3+H2SO4=2NaHCO3+Na2SO4;然后发生的反应是:2NaHCO3+H2SO4= Na2SO4+2H2O+2CO2↑;在上述过程中生成二氧化碳的质量与加入稀硫酸质量的关系如图甲所示。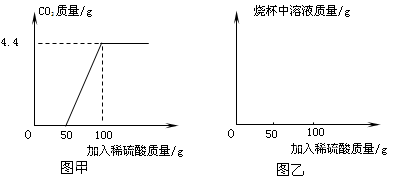
①请你根据以上信息,在图乙的坐标系中画出检测过程中烧杯中溶液的质量随滴加硫酸溶液质量的变化曲线。
②计算该样品中纯碱的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com