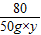(1)配制5000g溶质质量分数为10%的稀硫酸,需要98%的浓硫酸质量为多少?
(2)实验室用上述配好的10%的稀硫酸98g与50g某氢氧化钠溶液刚好完全中和.试求:该氢氧化钠溶液中,溶质质量分数是多少?
【答案】
分析:(1)根据加水稀释前后溶液中溶质质量不变,由稀释后的硫酸溶液质量及质量分数计算所需要浓硫酸的质量;
(2)根据反应的化学方程式,由恰好完全反应时所消耗硫酸的质量计算消耗氢氧化钠的质量,氢氧化钠质量与该溶液质量比可计算氢氧化钠溶液中溶质质量分数.
解答:解:(1)设需要98%的浓硫酸质量为x
5000g×10%=x×98%
x=510.2g
(2)设氢氧化钠溶液中溶质质量分数为y
H
2SO
4 +2NaOH═Na
2SO
4+2H
2O
98 80
98g×10% 50g×y
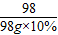
=
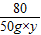
y=16%
答:需要98%的浓硫酸质量为510.2g,该氢氧化钠溶液中溶质质量分数为16%.
点评:根据反应的化学方程进行计算时,所使用的物质的质量都为纯净物质的质量,不能直接把溶液的质量代入化学方程式进行计算.

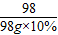 =
=