
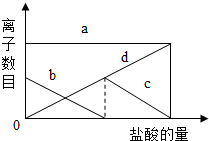
 向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡.随着盐酸的加入,溶液中离子数目也相应地发生变化.(提示:先后发生的反应为:
向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡.随着盐酸的加入,溶液中离子数目也相应地发生变化.(提示:先后发生的反应为:| A. | a:K+; b:CO32-; c:HCO3-; d:Cl- | |
| B. | a:K+; b:CO32-; c:Cl-; d:HCO3- | |
| C. | a:Cl-; b:K+; c:CO32-; d:HCO3- | |
| D. | a:K+; b:HCO3-; c:Cl-; d:CO32- |
分析 因考虑K2CO3在溶液中电离出K+和CO32-,盐酸溶液中存在H+、Cl-,因而出现CO32-+ H+═HCO3-,然后HCO3-+ H+═H2O+CO2,因向一定量的K2CO3溶液中缓慢地滴加稀盐酸,即出现如图现象.
解答 解:A、因在碳酸钾溶液中K2CO3═2K++CO32-,所以溶液开始就存在K+和CO32-并且K+和CO32-的个数比为2:1,根据图象显示,CO32-+ H+═HCO3-因而CO32-不断减少,因而a 为 K+,b 为 CO32-. 盐酸加到一定程度才产生气泡是因为碳酸开始分解的缘故,生成的KCl在溶液中仍存在Cl-;因而Cl-在图象中随着加盐酸就出现了,所以d必代表Cl-.随着碳酸的不断分解,HCO3-逐渐减少直到消失.因而c必代表HCO3-.故 正确.
B、当向一定量的K2CO3溶液中缓慢地滴加稀盐酸,溶液中出现H+、Cl-,并且CO32-+ H+═HCO3-,H++HCO3-═H2CO3.碳酸分解生成水和二氧化碳,这就是向一定量的K2CO3溶液中缓慢地滴加稀盐酸,不断搅拌,发现开始没产生气泡的原因;结合 A 项选答,故B 不正确.
C、因在碳酸钾溶液中K2CO3═2K++CO32-,所以溶液开始就存在K+和CO32-并且K+和CO32-的个数比为2:1,根据图象显示,CO32-+ H+═HCO3-因而CO32-不断减少,因而a 为 K+,b 为 CO32-. 故不正确.
D、通过以上选项分析解答,故D 不正确.
故选 A.
点评 此题既考查学生对酸的性质理解运用,有渗透离子反应的实质,还锻炼学生的良好推断能力.可谓难题.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:初中化学 来源: 题型:选择题
| A. | 矿石 | B. | 合金 | C. | 合成材料 | D. | 复合材料 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 粒子的结构示意图 | 粒子类型(填原子、阴离子、阳离子) | 粒子所带的电荷、 种类和数目 | 化合价 |
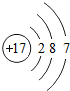 | 原子 | 不显电性 | 0 |
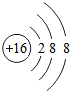 | 阴离子 | 2个单位的负电荷 | -2 |
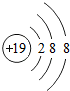 | 阳离子 | 一个单位的正电荷 | +1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
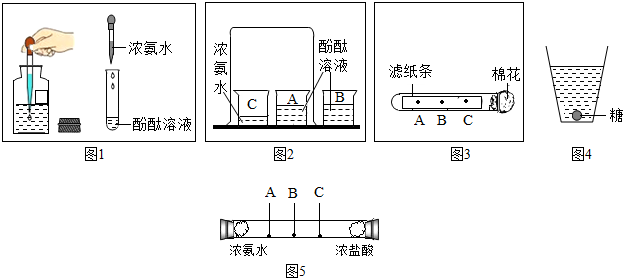
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 硫化氢(H2S)是一种具有臭鸡蛋气味的致命毒气,它的密度比空气大,可溶于水形成氢硫酸,氢硫酸具有酸的通性.实验室常用固体硫化亚铁(FeS)和稀硫酸在常温下制得H2S,同时生成FeS04.化学方程式为
硫化氢(H2S)是一种具有臭鸡蛋气味的致命毒气,它的密度比空气大,可溶于水形成氢硫酸,氢硫酸具有酸的通性.实验室常用固体硫化亚铁(FeS)和稀硫酸在常温下制得H2S,同时生成FeS04.化学方程式为查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 小刚和小洁以“化学反应中,反应物和生成物的质量关系”为课题进行科学探究.
小刚和小洁以“化学反应中,反应物和生成物的质量关系”为课题进行科学探究.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com