
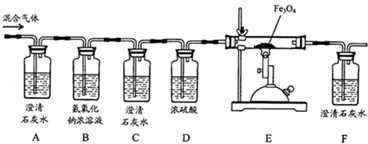



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
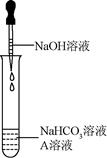
| | NaHCO3ČÜŅŗ | NaOHČÜŅŗ | Na2CO3ČÜŅŗ |
| ¼ÓČėĻ”ŃĪĖį | ĻÖĻó¢ń | ĪŽĆ÷ĻŌ±ä»Æ | ²śÉśĘųÅŻ |
| ¼ÓČė³ĪĒåŹÆ»ŅĖ® | ČÜŅŗ±ä»ė×Ē | ĪŽĆ÷ĻŌ±ä»Æ | ĻÖĻó¢ņ |
| ¼ÓČėCaCl2ČÜŅŗ | ĪŽĆ÷ĻŌ±ä»Æ | ČÜŅŗ±ä»ė×Ē | ČÜŅŗ±ä»ė×Ē |
| ¼ÓČČČÜŅŗÖĮ·ŠĢŚ£¬½« ĘųĢåĶØČė³ĪĒåŹÆ»ŅĖ® | ³ĪĒåŹÆ»ŅĖ® ±ä»ė×Ē | ³ĪĒåŹÆ»ŅĖ® ĪŽĆ÷ĻŌ±ä»Æ | ³ĪĒåŹÆ»ŅĖ® ĪŽĆ÷ĻŌ±ä»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
| | ŹµŃé²Ł×÷ | ŹµŃéĻÖĻó | ŹµŃé½įĀŪ»ņ×ܽį | |
| ø÷²½Öč½įĀŪ | ×ܽį | |||
| ŹµŃéŅ» | ½«ĀČĖį¼Ų¼ÓČČÖĮČŪ»Æ£¬ÉģČė“ų»šŠĒµÄľĢõ | ľĢõø“Č¼ | ĀČĖį¼ŲŹÜČČ·Ö½āÄܲśÉśŃõĘų£¬µ«ŹĒ ”£ | ¶žŃõ»ÆĆĢŹĒĀČĖį¼ŲŹÜČČ·Ö½āµÄ“߻ƼĮ |
| ŹµŃ鶞 | ¼ÓČȶžŃõ»ÆĆĢ£¬ÉģČė“ų»šŠĒµÄľĢõ£¬ | ľĢõ²»ø“Č¼ | ¶žŃõ»ÆĆĢŹÜČČ²»²śÉśŃõĘų”£ | |
| ŹµŃéČż | | ľĢõŃøĖŁø“Č¼ | ¶žŃõ»ÆĆĢÄܼÓæģĀČĖį¼ŲµÄ·Ö½āĖŁ¶Č”£ | |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
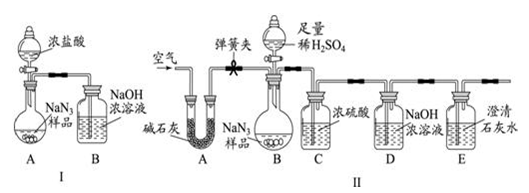
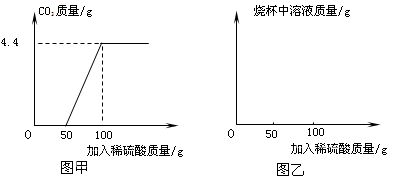
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
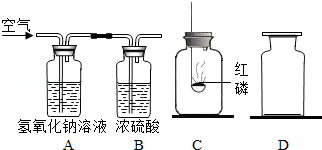
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
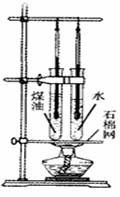
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ŌŚ¼×Ķ黚ŃęÉĻ·½ÕÖŅ»øöøɶųĄäµÄÉÕ±£¬Ķعż²śÉśĖ®µÄĻÖĻóÖ¤Ć÷¼×ĶéÖŠŗ¬ÓŠĒāŌŖĖŲ |
| B£®½«×ćĮæµÄĶĖæ·ÅŌŚ³äĀśæÕĘųµÄĆܱÕČŻĘ÷ÖŠ¼ÓČČ£¬ŅŌ³żČ„ĘäÖŠµÄO2 |
| C£®½«50gČÜÖŹÖŹĮæ·ÖŹżĪŖ10%µÄŃĪĖį¼ÓČČÕō·¢25gĖ®£¬µĆµ½ÖŹĮæ·ÖŹżĪŖ20%µÄŃĪĖį |
| D£®½«·ÓĢŖŹŌŅŗµĪČėCu(OH)2ÖŠ£¬Ķعż·ÓĢŖŃÕÉ«µÄ±ä»ÆÅŠ¶ĻCu(OH)2ŹĒ·ńŹōÓŚ¼ī |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā

| ŹµŃé²Ł×÷ | ĻÖĻó | ½įĀŪ |
| ȔɣĮæ°×É«¹ĢĢå¼ÓČėŹŹĮæŃĪĖį | ²śÉśĘųÅŻ | øĆ°×É«¹ĢĢå²»æÉÄÜŹĒ””_________”” |
| | | |
| ²śÉśµÄĘųĢåĶØČė³ĪĒåŹÆ»ŅĖ® | ŹÆ»ŅĖ®±ä»ė×Ē | |
| ²śÉśµÄĘųĢåĶØČėĘ·ŗģČÜŅŗ | ČÜŅŗĶŹÉ« | øĆ°×É«¹ĢĢå²»æÉÄÜŹĒ””_________”” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com