
| A. | 金刚烷中C、H原子的个数比为5:8 | |
| B. | 金刚烷的化学式为C10H16 | |
| C. | 金刚烷是一种无机物 | |
| D. | 金刚烷中氢元素的质量分数约为11.76% |
分析 A、根据1个金刚烷分子的构成进行分析判断.
B、根据题中信息进行判断.
C、根据含碳元素的化合物成为有机物进行判断.
D、根据化合物中元素的质量分数公式进行分析判断.
解答 解:A、金刚烷中C、H原子的个数比为10:16=5:8,故说法正确.
B、金刚烷是一种含有10个碳原子和16个氢原子的环状四面体烃,因此金刚烷的化学式为C10H16,故说法正确.
C、金刚烷是由碳、氢两种元素组成的化合物,属于有机物,说法错误;
D、金刚烷中氢元素的质量分数约为$\frac{16}{12×10+16}$×100%≈11.76%,故说法正确.
故选C.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:初中化学 来源: 题型:选择题
| A. | pH等于8的溶液一定是碱的溶液 | |
| B. | 不饱和溶液变为饱和溶液溶质质量分数一定变大 | |
| C. | 所有的酸与活泼金属反应一定能生成氢气 | |
| D. | 金属与酸溶液发生置换反应时,生成的溶液质量一定大于原来酸溶液的质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
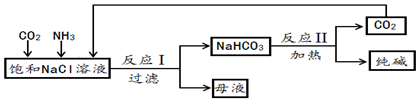
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 食盐是人们生活中不可缺少的调味剂,随着人们健康意识的提高,市场上出现了“加碘盐”、“叶绿素锌钠盐”、“低钠盐”等.某种低钠盐由NaCl、KCl、MgSO4三种物质组成,用它进行以下实验(假设每步均恰好完全反应).
食盐是人们生活中不可缺少的调味剂,随着人们健康意识的提高,市场上出现了“加碘盐”、“叶绿素锌钠盐”、“低钠盐”等.某种低钠盐由NaCl、KCl、MgSO4三种物质组成,用它进行以下实验(假设每步均恰好完全反应).查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 质量分数 | 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 98% |
| 密度(g/mL) | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.80 | 1.84 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
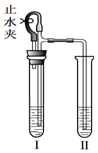 用如图所示装置分别进行以下实验.
用如图所示装置分别进行以下实验.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
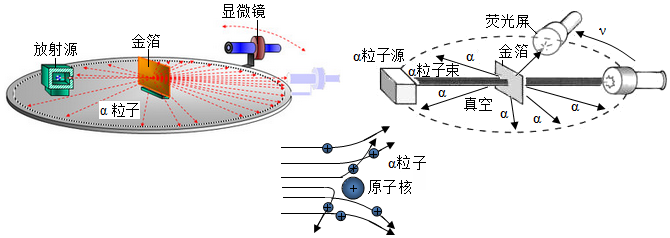
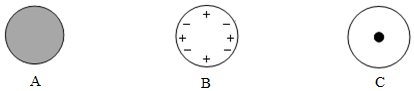
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com