
| A. | 地球上水量丰富,水资源是取之不尽用之不竭的 | |
| B. | 过滤可以除去水中不溶性的固体杂质 | |
| C. | 净化水的操作中,净化程度最高的是蒸馏 | |
| D. | 向水中加入吸附剂(如活性炭等)可以除去水中的部分杂质,但不能降低水的硬度 |
分析 A、根据有关水资源的知识进行判断;
B、根据过滤的原理解答;
C、根据净化水的方法解答;
D、根据活性炭有吸附性,降低水的硬度是加热煮沸解答.
解答 解:
A、地球上水资源丰富,但跟人类关系密切的淡水只约占地球总水量的2.5%,其中供人类直接利用的淡水仅约占地球总水量的0.3%,一些地区已经出现了水危机,因此淡水不是取之不尽,用之不竭的,故错误;
B、过滤操作是除去液体中不溶性杂质的方法,过滤可以除去水中不溶性的固体杂质,故正确;
C、净化水的操作中,净化程度最高的是蒸馏,蒸馏可以得到纯水,故正确;
D、活性炭有吸附性所以吸附水中的某些杂质,但不能降低水的硬度,降低水的硬度是加热煮沸,故正确;
答案:A.
点评 此题是有关水的净化的一些知识,其中有过滤是出不溶性杂质,活性炭吸附杂质臭味.蒸馏是得到较纯净水的一种方法.


科目:初中化学 来源: 题型:实验探究题
 FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.| 序号 | H2O2溶液的体积/mL | H2O2溶液的浓度/% | 2%FeCl3溶液的体积/mL | 反应的时间/min | 生成O2的体积m/L |
| 1 | 10 | 30 | x | 5 | V1 |
| 2 | 10 | 15 | 3 | y | V2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

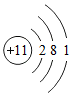 是钠元素的原子结构示意图.该原子在化学反应中易失去电子(填“得到”或“失去”)它在化学反应中形成的离子与Ne(填元素符号)原子具有相同的核外电子排布;
是钠元素的原子结构示意图.该原子在化学反应中易失去电子(填“得到”或“失去”)它在化学反应中形成的离子与Ne(填元素符号)原子具有相同的核外电子排布;查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com