
| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象 | 实验结论或总结 | ||
| 结论 | 总结 | |||
| 实验一 | 取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但是反应慢. | 二氧化锰是过氧化氢分解的催化剂 |
| 实验二 | 向盛水的试管中加入二氧化锰,伸入带火星的木条 | 没有明显现象 | 二氧化锰加入水中不产生氧气. 二氧化锰加入水中不产生氧气. . | |
| 实验三 | 向盛有5mL5%过氧化氢溶液的试管中加入二氧化锰,伸入带火星的木条 向盛有5mL5%过氧化氢溶液的试管中加入二氧化锰,伸入带火星的木条 . |
有大量气泡产生,带火星的木条迅速复燃 有大量气泡产生,带火星的木条迅速复燃 . |
二氧化锰能加快过氧化氢的分解 | |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 主要实验现象 | 实验结论和解释 |
| 另取样于试管加入过量的CaCl2溶液,静置后,取上层清液,滴入酚酞试液 | ① 产生白色沉淀 产生白色沉淀 ;② 溶液变红色 溶液变红色 ; |
该溶液是变质的NaOH溶液. |
查看答案和解析>>
科目:初中化学 来源: 题型:
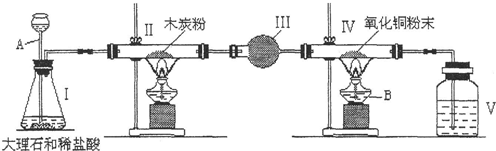
| ||
| ||
| 反虑前 | 反应后 | |
| 硬质玻管+样品的质量 | 40.0g | 38.4g |
查看答案和解析>>
科目:初中化学 来源: 题型:
 某学校化学兴趣小组的同学用洁净的塑料瓶从运河中取回一定量的水样,然后进行如下实验探究:
某学校化学兴趣小组的同学用洁净的塑料瓶从运河中取回一定量的水样,然后进行如下实验探究:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com