

分析 (1)金属与盐发生置换反应生成金属和盐.把锌粉和铜粉加到AgNO3溶液中,充分反应后过滤,所得滤渣一定为金属单质,且是锌、铜、银中的一种或几种.往得到的滤液中滴氯化钠,有白色沉淀生成,则滤液中一定有剩余的硝酸银,故得到的金属一定是银,没有铜锌;
(2)若溶液甲呈无色,说明没有硝酸铜,即铜没与硝酸银反应,只有锌与硝酸银反应生成了硝酸锌和银;
(3)若溶液甲呈蓝色,说明有硝酸铜,根据金属活动性,锌粉会先和硝酸银反应,然后和铜再与硝酸银反应,故溶液甲中含有的溶质一定有硝酸铜和硝酸锌;故乙中一定没有锌.
解答 解:(1)锌、铜与AgNO3反应生成硝酸锌和硝酸铜、银;根据金属活动性,锌粉会先和硝酸银反应,然后和铜再与硝酸银反应,往得到的滤液中滴氯化钠,有白色沉淀生成,则滤液中一定有剩余的硝酸银,锌、铜不足,滤渣中含有银,产生白色沉淀的方程式为 NaCl+AgNO3═AgCl↓+NaNO3.该反应属于复分解反应;
故答案为:NaCl+AgNO3═AgCl↓+NaNO3.
(2)若溶液甲呈无色,说明没有硝酸铜,即铜没与硝酸银反应,只有锌与硝酸银反应生成了硝酸锌和银;发生反应的化学方程式Zn+2AgNO3═Zn(NO3)2+2Ag;
答案:Zn+2AgNO3═Zn(NO3)2+2Ag;
(3)若溶液甲呈蓝色,说明有硝酸铜,根据金属活动性,锌粉会先和硝酸银反应,然后和铜再与硝酸银反应,故溶液甲中含有的溶质一定有硝酸铜和硝酸锌;故乙中一定没有锌,此时若将固体乙投入稀盐酸时无气泡产生.
答案:Zn(NO3)2、Cu(NO3)2;无.
点评 题中的“往滤液中加入稀盐酸,白色沉淀产生”是个重要现象,这个现象隐藏了“硝酸银过量”的关键性条件,本题考查了金属活动性顺序的应用.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
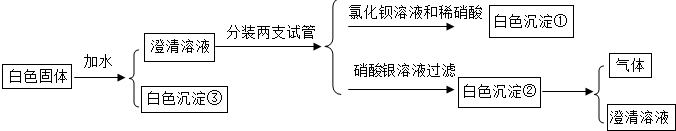
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
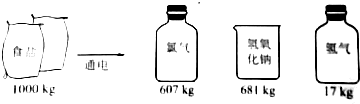
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 做细铁丝在氧气中燃烧的实验时,集气瓶内要预留少量水 | |
| B. | 稀释浓硫酸时,将浓硫酸沿内壁缓缓注入盛有水烧杯中 | |
| C. | 做一氧化碳还原氧化铁实验时,先通一氧化碳后加热 | |
| D. | 测定溶液酸碱度时,直接将pH试纸伸入待测溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com