
分析 【实验探究1】
水蒸气冷凝后变成水珠;
氢氧化钙和二氧化碳反应生成碳酸钙和水;
【反思质疑】
饱和氢氧化钙溶液温度升高时会析出固体;
【交流讨论】
石蜡不完全燃烧能生成炭黑等物质;
【实验探究3】
棉花可以阻止炭黑和氧化铁接触;
氧化铁在高温条件下能和一氧化碳反应生成铁和二氧化碳;
铁在高温条件下能够被空气中的氧气氧化;
增大可燃物与氧气的接触面积,增大氧气的浓度,都能够促进可燃物燃烧.
解答 解:【实验探究1】
(1)用干冷的小烧杯罩在蜡烛火焰上,观察到烧杯内壁出现水珠,证明有水生成.
(2)二氧化碳和石灰水反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
故填:烧杯内壁出现水珠;Ca(OH)2+CO2═CaCO3↓+H2O.
【反思质疑】
石灰水变浑浊不一定是生成了碳酸钙,还可能是饱和石灰水受热后析出了氢氧化钙.
故填:析出了氢氧化钙.
【交流讨论】
“实验探究2”中,集气瓶内壁上的黑色粉末可能是石蜡不完全燃烧生成的炭黑.
故填:炭黑.
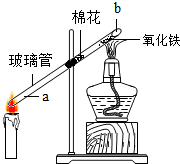
【实验探究3】
(2)为了阻止炭黑和氧化铁反应,在玻璃管中部,提前放入了一团棉花;
(3)一会儿,红棕色氧化铁逐渐变成黑色,证明蜡烛不完全燃烧确实有一氧化碳生成;
b端发生反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)为防止玻璃管b端生成的黑色物质又被氧化,接下来的操作是先熄灭酒精灯,一会儿后再熄灭蜡烛.
故填:炭黑和氧化铁反应;红棕;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;先熄灭酒精灯,一会儿后再熄灭蜡烛.
【拓展应用】
为使其完全燃烧,可以采取的方法是:增大可燃物与氧气的接触面积,增大氧气的浓度.
故填:增大燃料和氧气的接触面积.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 实验①:取少量滤液于试管中,加入适量的纯碱溶液,振荡. | 无明显现象 | 猜想Ⅱ不成立 |
| 实验②取少量滤液于试管中,滴加适量的BaCl2溶液(写溶质的化学式),振荡. | 产生白色沉淀 | 猜想Ⅲ成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用燃磷法测定空气中氧气的体积含量 | |
| B. | 除去烧碱中混有的纯碱,可以使用稀盐酸 | |
| C. | 测定未知溶液的pH时,要先将pH试纸用水湿润 | |
| D. | 稀释浓硫酸时,向浓硫酸中缓缓加水,并用玻璃棒搅拌 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K2CO3 | B. | NH4NO3 | C. | Ca(H2PO4)2 | D. | NH4HCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com