

分析 根据硫酸铜在溶液中显蓝色,碳酸钙在高温的条件下分解生成氧化钙和二氧化碳,硫酸根离子和钡离子反应会生成硫酸钡沉淀等知识进行分析.
解答 解:硫酸铜在溶液中显蓝色,碳酸钙在高温的条件下分解生成氧化钙和二氧化碳,硫酸根离子和钡离子反应会生成硫酸钡沉淀.
(1)白色固体加水溶解经过操作I,得到了固体甲和溶液A,加入硝酸钡后经过操作II得到了溶液B和固体丙,所以操作Ⅰ、Ⅱ的名称是过滤;
(2)7.33g的固体甲,充分灼烧得到了5.13g的固体乙和无色气体,所以无色气体的质量是:7.33g-5.13g=2.2g;
(3)固体甲加过经过加热灼烧,得到了固体乙和无色气体,所以固体甲中一定含有碳酸钙和硫酸钡;
(4)白色固体加水溶解,过滤后,得到无色溶液,所以这种白色粉末中一定不含有硫酸铜;
(5)依据二氧化碳的质量计算碳酸钙的质量和生成氧化钙的质量,
设参加反应的碳酸钙质量为x,生成二氧化碳质量为y,
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 56 44
x y 2.2g
$\frac{100}{x}$=$\frac{56}{y}$=$\frac{44}{2.2g}$
x=5g
y=2.8g
所以固体乙中含有硫酸钡的质量为:5.13g-2.8g=2.33g,
设样品中参加反应的硫酸钠的质量为m,硝酸钡的质量为n
Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3,
142 261 233
m n 2.33g
$\frac{142}{m}$=$\frac{261}{n}$=$\frac{233}{2.33g}$
m=1.42g
n=2.61g
第二次加硝酸钡后参加反应的硫酸钠的质量为z
Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3,
142 233
z 4.66g
$\frac{142}{z}$=$\frac{233}{4.66g}$
z=2.84g
(5)白色粉末中肯定含有的物质总质量为:5g+2.61g+2.84g+1.42g=11.87g.
故答案为:(1)过滤;
(2)2.2;
(3)硫酸钡、碳酸钙;
(4)硫酸铜;
(5)11.87g.
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 两个氢分子:2H | |
| B. | 2个硫酸根离子:2SO4-2 | |
| C. | 水中氧元素的化合价为-2 价:H2$\stackrel{-2}{O}$ | |
| D. | 两个氮原子:N2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 丁的化学式为H2O,该反应为置换反应 | |
| B. | 参加反应的甲与乙的质量比为3:1 | |
| C. | 甲是单质,乙、丙、丁均为氧化物 | |
| D. | 该反应体现了无机物可以转化为有机物 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染.某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、Pd(钯,银白色).如图是某工厂回收其中部分金属的流程图.(假设流程图中各反应均恰好完全反应.已知:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O)
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染.某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、Pd(钯,银白色).如图是某工厂回收其中部分金属的流程图.(假设流程图中各反应均恰好完全反应.已知:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O)
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 废水中的主要污染物 | 处理措施 | 方法类别 |
| A | 不溶性颗粒物 | 加明矾 | 结晶法 |
| B | 异味物质 | 加活性炭 | 吸附法 |
| C | 氯化铜 | 加硫酸钠 | 过滤法 |
| D | 纯碱 | 加石灰水 | 蒸馏法 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
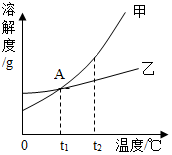 甲、乙物质的溶解度曲线如图所示.下列有关甲、乙物质的说法不正确的是( )
甲、乙物质的溶解度曲线如图所示.下列有关甲、乙物质的说法不正确的是( )| A. | t1℃时甲、乙两物质的溶解度相同 | |
| B. | 甲物质在热水中的溶解度比在冷水中的大 | |
| C. | t2℃时将甲、乙的饱和溶液降温至t1℃,甲析出的晶体比乙析出的多 | |
| D. | 将乙饱和溶液蒸发溶剂后恢复至原温度,有结晶析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 由三种非金属和一种金属组成 | B. | 属于氧化物 | ||
| C. | 含有5个氢分子 | D. | C6H10FeO6中C、O的质量比为3:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com