
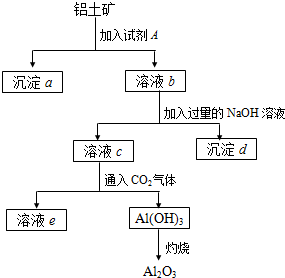
 21、铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题
21、铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题

 全优点练单元计划系列答案
全优点练单元计划系列答案科目:初中化学 来源: 题型:
| A、340t | B、204t | C、108t | D、120t |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?天河区二模)金属材料在生活和化学实验中有广泛应用.
(2013?天河区二模)金属材料在生活和化学实验中有广泛应用.
| ||
| 电解 |
查看答案和解析>>
科目:初中化学 来源:2009年山东省济南外国语学校实验班初中升高中保送生化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com