
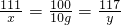
 =15.6%
=15.6%

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2013-2014学年江苏省宜兴市九年级上学期期未考试化学试卷(解析版) 题型:计算题
某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示。
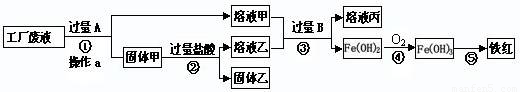
回答下列问题:
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 。
(2)工厂废液中加入过量A反应的化学方程式为 。
(3)固体乙的主要成分是 。
(4)铁红是炼铁的主要原料,用CO和铁红炼铁的化学方程式为 。
(5)某研究性学习小组的同学为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中
称取生铁样品5.8g放入烧杯中,然后再加入足量的稀硫酸,使之充分反应后,共收
集到0.2g氢气(杂质不参加反应)。则该生铁样品中铁的质量分数为 。(列出计算过程,保留一位小数。)
查看答案和解析>>
科目:初中化学 来源:2013-2014学年江苏省宜兴市九年级上学期期未考试化学试卷(解析版) 题型:计算题
某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示。
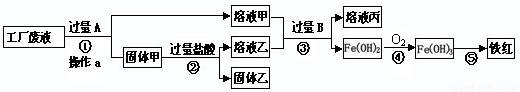
回答下列问题:
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 。
(2)工厂废液中加入过量A反应的化学方程式为 。
(3)固体乙的主要成分是 。
(4)铁红是炼铁的主要原料,用CO和铁红炼铁的化学方程式为 。
(5)某研究性学习小组的同学为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中
称取生铁样品5.8g放入烧杯中,然后再加入足量的稀硫酸,使之充分反应后,共收
集到0.2g氢气(杂质不参加反应)。则该生铁样品中铁的质量分数为 。(列出计算过程,保留一位小数。)
查看答案和解析>>
科目:初中化学 来源:2013-2014学年江苏省宜兴市九年级上学期期未考试化学试卷(解析版) 题型:计算题
某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示。

回答下列问题:
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 。
(2)工厂废液中加入过量A反应的化学方程式为 。
(3)固体乙的主要成分是 。
(4)铁红是炼铁的主要原料,用CO和铁红炼铁的化学方程式为 。
(5)某研究性学习小组的同学为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中
称取生铁样品5.8g放入烧杯中,然后再加入足量的稀硫酸,使之充分反应后,共收
集到0.2g氢气(杂质不参加反应)。则该生铁样品中铁的质量分数为 。(列出计算过程,保留一位小数。)
查看答案和解析>>
科目:初中化学 来源:2013-2014学年江苏省宜兴市九年级上学期期未考试化学试卷(解析版) 题型:计算题
某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示。
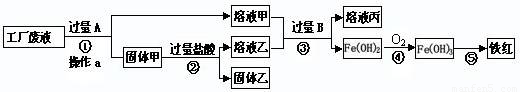
回答下列问题:
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 。
(2)工厂废液中加入过量A反应的化学方程式为 。
(3)固体乙的主要成分是 。
(4)铁红是炼铁的主要原料,用CO和铁红炼铁的化学方程式为 。
(5)某研究性学习小组的同学为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中
称取生铁样品5.8g放入烧杯中,然后再加入足量的稀硫酸,使之充分反应后,共收
集到0.2g氢气(杂质不参加反应)。则该生铁样品中铁的质量分数为 。(列出计算过程,保留一位小数。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com