
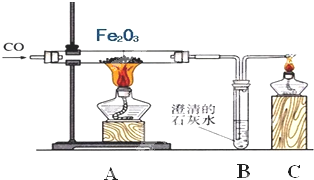
 钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要.甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定.(所取赤铁矿的质量为20克)
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要.甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定.(所取赤铁矿的质量为20克)
| ||
| 3×16 |
| 3×16+2×56 |
| 16g |
| 20g |
| ||


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:初中化学 来源: 题型:
| 方案 | 优点 |
| 甲组 | ① |
| 乙组 | ② |
查看答案和解析>>
科目:初中化学 来源: 题型:
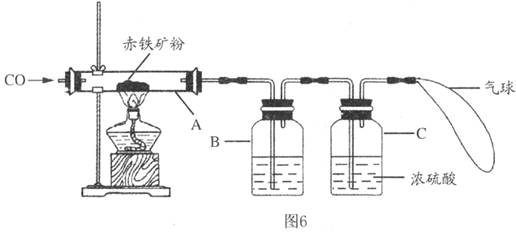
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中的杂质性质稳定,既不溶于水也不参与反应)
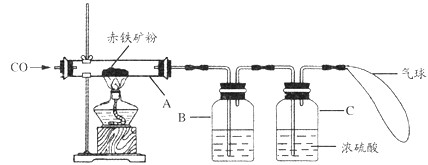
(1)甲组同学称取一定质量的赤铁矿粉,采用如图装置进行实验。
①装置A中发生反应的化学方程式是_______________________________。
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是浓__________溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量。
方法一:称量反应前后装置A的总质量,计算出Fe2O3的含量。
方法二:称量_______,得出反应生成的CO2的质量,计算出Fe2O3的含量。
(2)乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应,_______(填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
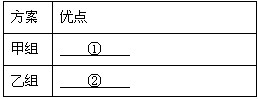
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价。

查看答案和解析>>
科目:初中化学 来源:人教新课标初三上册第一、二章专项训练 题型:推断题
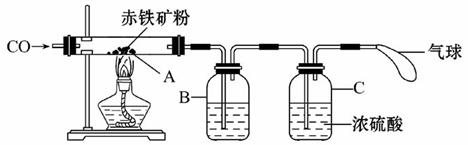
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应)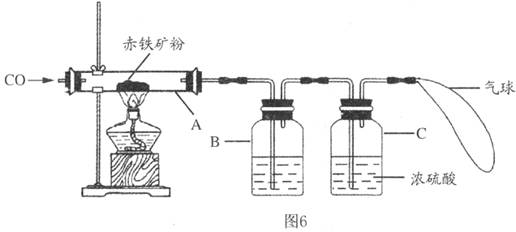
(1)甲组同学称取一定质量的赤铁矿粉,采用如图6的装置进行实验。
①装置A中发生反应的化学方程式是 。
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是 浓溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量:
【方法一】称量反应前后A装置的总质量,计算出Fe2O3的含量;
【方法二】称量 得出反应生成的CO2质量,计算出Fe2O3的含量。
(2)乙组同学称取等质量的赤铁矿粉放人烧杯中,向烧杯中加入过量的稀硫酸充分反应,
(填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价。
| 方案 | 优点 |
| 甲组 | ① |
| 乙组 | ② |
查看答案和解析>>
科目:初中化学 来源:江苏中考真题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com