
(7分) 某学生做了如下图所示的实验。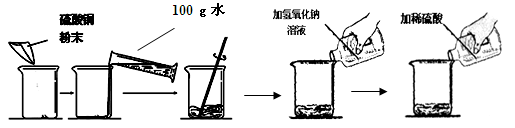
| | 第一次 | 第二次 |
| 加入硫酸铜的质量 | m | m |
| 加入氢氧化钠溶液的质量 | 50g(溶质质量分数16%) | 50g(溶质质量分数16%) |
| 加入稀硫酸的质量 | 50g | 100g |
| 实验现象 | 蓝色固体和蓝色溶液 | 蓝色溶液 |
(1)CuSO4+2NaOH=Na2SO4+Cu(OH)2↓ Cu(OH)2+H2SO4= CuSO4+2H2O
(2)CuSO4 Na2SO44 (3)80/98=8g/x
(4)16g (5)7.6% ( 6)135g
解析试题分析:(1)实验中发生反应的化学方程式,一是氢氧化钠溶液与硫酸铜溶液反应:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓,二是生成的氢氧化铜与硫酸反应:Cu(OH)2+H2SO4= CuSO4+2H2O
(2)第一次实验后,看到的实验现象蓝色固体和蓝色溶液,所以溶液中所含溶质的化学式为:CuSO4 Na2SO44
(3) 根据化学方程式:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓中氢氧化钠与氢氧化铜的质量关系为80:98,而氢氧化钠的质量=50g×16%=8g,所以实验中生成氢氧化铜沉淀的质量(x)的比例式:80/98=8g/x
(4)同样根据化学方程式:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓中氢氧化钠与硫酸铜的质量关系为80:160,而氢氧化钠的质量="50g×16%=8g," 实验中加入硫酸铜的质量(m)为16g
(5)根据第(4)问,已经计算出溶质硫酸铜的质量为16g,而最终溶液的总质量=16g+50g+100g+43.8g=209.8g,所以所得溶液中溶质的质量分数为=16g/209.8g×100%=7.6%
(6)先计算出稀硫酸的溶质质量分数,根据化学方程式:Cu(OH)2+H2SO4= CuSO4+2H2O中硫酸与硫酸铜的质量关系为80:160,求出溶质硫酸的质量,
解:设溶质硫酸的质量为x
Cu(OH)2+H2SO4= CuSO4+2H2O
160
X 16g
98:160=x:16g
X=9.8g
所以硫酸溶液中溶质的质量分数=9.8g/100g×100%=9.8%
因为两次实验总共消耗硫酸的质量为50g+100g=150g,根据溶液稀释过程中,溶质的质量不变,可设需要加水的质量为y,可列式为:(150g-y)×98%=150×9.8%,所以y=135g
考点:酸碱盐的化学性质,根据化学方程式计算


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:单选题
在某H2O2溶液中氢元素与氧元素的质量比为2:17,现向19g该H2O2溶液中加入1g二氧化锰,充分反应后,生成氧气的质量为
( )
| A.1g | B.1.6g | C.4.2g | D.8.5g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示。当滴入碳酸钠溶液至图中A点时,通过计算确定所得溶液是否为饱和溶液。(提示:20℃时,氯化钠溶解度为36克。)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
小明在实验室里加热31.6g高锰酸钾制取氧气,完全反应后剩余固体质量为28.4g。将剩余固体溶解、过滤、烘干上,回收二氧化锰。请计算:
(1)生成氧气的质量为 g。
(2)回收二氧化锰的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(6 分)镁是一种用途广泛的金属材料,目前大部分镁都是利用从海水中提取的镁盐 制取的。某校化学活动小组欲测定海水中氯化镁的含量,取海水样品 200g,加入适量 氢氧化钠溶液,至恰好完全反应为止,称量所得沉淀物的质量为 0.58g。 请你根据上述资料,回答下列问题:
⑴金属镁的物理性质有: 。(答出一条即可)
⑵查阅资料可知,海水中镁元素的含量比较低,所以,从海水中提取 MgCl2 时, 经历了“MgCl2 → Mg(OH)2 → MgCl2”的转化过程,请分析这样做的目的是
⑶列式计算:上述 200g 海水样品中,所含 MgCl2 的质量是多少?
(提示:MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl )
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(12分)下图是某同学完成《实验活动5 一定质量分数的氯化钠溶液的配制》中“配制
50 g质量分数为6%的氯化钠溶液”的全过程。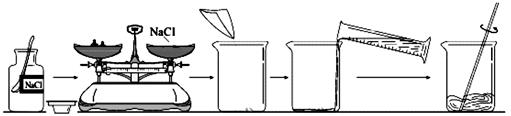
(1)图中的错误有:
① ;
② 。
(2)若所配制的盐水中NaCl 的质量分数小于6%,则可能造成误差的原因有(至少举
出两点)。
① ;
② 。
(3)由浓溶液配制稀溶液时,计算的依据是 。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是 。在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、冷却至室温装瓶并贴上标签。
(4)取某稀硫酸样品10g,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌。溶液pH的变化如图所示。试回答: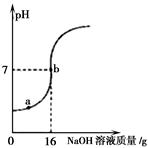
①a点溶液中含有的离子有 。
②当pH=7时,消耗NaOH溶液中NaOH的质量为 g。
③计算稀硫酸的溶质质量分数。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为测定部分变质的烧碱中氢氧化钠的质量分数,称取样品5.3g,加入10%的氯化钡溶液,至沉淀不再产生,洗涤、烘干、称量后得到沉淀0.01mol。
① 写出氢氧化钠变质的化学方程式 。
② 求样品中氢氧化钠的质量分数。(根据化学方程式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某兴趣小组用10g镁条与溶质质量分数为49%的稀硫酸反应.测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,没有其它杂质)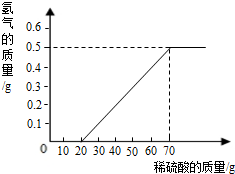
(1)当稀硫酸的质量为70g,产生的氢气的质量为0.5g
(2)用化学方程式说明当稀硫酸的质量为10g时,为什么不产生氢气 ;
(3)计算镁条中镁元素的质量分数(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)28.7g的氯化钠和硝酸钠的混合物,溶于100g水中,向所得溶液中加入134g的硝酸银溶液,恰好完全反应,得到溶液的质量是234g。计算:原混合物中钠元素的质量分数。(已知:AgNO3 + NaCl = AgCl↓+ NaNO3;计算结果精确到1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com