
| A. | 分子 | B. | 原子 | C. | 离子 | D. | 元素 |
科目:初中化学 来源: 题型:选择题
| A. | 剩余固体是混合物 | B. | 生成CO2的质量是20g | ||
| C. | 剩余固体的质量是42g | D. | 原混合物中CaCO3的质量是30g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaCl Ca(ClO)2 KClO3 | B. | Cl2 HCl ClO2 | ||
| C. | KClO3 NaClO2 HClO4 | D. | NH4ClO4 Cl2O3 HClO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
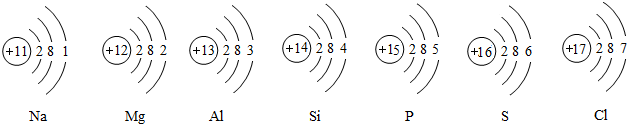
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 工业纯碱标准:(Na2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
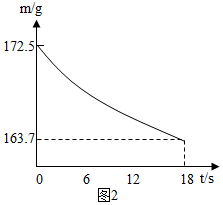
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com