
分析 (1)根据溶质的质量=溶液的质量×溶液中溶质的质量分数来分析;
(2)根据化学方程式,利用氯化氢的质量来计算氢氧化钠的质量.
解答 解:(1)配制200克10%的氢氧化钠溶液时,需要氢氧化钠的质量为:200g×10%=20g;故填:20;
(2)设剩余废液中含氢氧化钠的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 100g×14.6%
$\frac{40}{36.5}=\frac{x}{100g×14.6%}$
x=16g
答:剩余废液中含氢氧化钠溶质16g.
点评 本题考查了根据化学方程式的计算,完成此题,关键是找准反应的原理,找出各物质之间的质量关系然后列比例式计算.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:初中化学 来源: 题型:选择题

| A. | ①干燥氢气 | B. | ②检验氧气是否集满 | ||
| C. | ③检验X溶液中是否含有SO42- | D. | ④验证Zn、Fe、Cu的活动性强弱 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 氢氧化钙长期存放容易变质.某小组在实验时取了一瓶存放多年的氢氧化钙来检查变质情况.取12.2g样品,加入32.8g水,形成悬浊液,然后逐渐滴加29.2%的盐酸充分反应.加入盐酸的质量与锥形瓶中物质的质量关系如图.
氢氧化钙长期存放容易变质.某小组在实验时取了一瓶存放多年的氢氧化钙来检查变质情况.取12.2g样品,加入32.8g水,形成悬浊液,然后逐渐滴加29.2%的盐酸充分反应.加入盐酸的质量与锥形瓶中物质的质量关系如图.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 操作序号 | 1 | 2 | 3 | 4 |
| 加入硝酸钾的质量/克 | 40 | 50 | 60 | 70 |
| 溶液的质量/克 | 90 | 100 | 105 | 105 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实 验 步 骤 | 简 答 |
(1)称取3g氯酸钾与少量二氧化锰混合后放入装置①的试管中,点燃酒精灯. | 装入药品前要检查装置的气密性 ; 分别用中文名称和化学符号写出a试管中发生反应的表达式:氯酸钾$→_{加热}^{二氧化锰}$氯化钾+氧气;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑. |
(2)加热试管一段时间后,再用橡皮管连接a、b;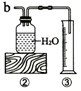 当装置②中水面不再下降,断开a、b,移去酒精灯. | 为什么“加热试管一段时间后,再用橡皮管连接a、b”?原因是:一开始排出的是试管中的空气; ③中使用量筒的作用是通过测量水的体积测量收集的氧气体积. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com