
分析 A、反应前后各元素的化合价不一定变化;
B、根据物质参加化学反应按一定的质量比进行;
C、根据质量守恒定律,必须是参加反应的物质质量之和.
解答 解:A、反应前后各元素的化合价不一定变化,故A错误;
B、物质参加化学反应按一定的质量比进行,由于参加反应的AB的质量比不一定是1:1,故若取xgA和xgB反应,生成C和D的质量总和不一定是2xg,故B正确;
C、参加反应的AB的质量总和一定等于生成的CD的质量总和,但反应物A和B的质量比不一定等于生成物C和D的质量比,故C错误.
故选B,可添加D为:在反应中A、B、C、D四种物质的粒子数目比为a:b:c:d.
点评 本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点,有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.


科目:初中化学 来源: 题型:解答题
 已知强酸、强碱、盐的水溶液,溶质均以离子的形式存在.如图所示,a容器中是盐酸,b容器中是氢氧化钠溶液,c溶器中是反应生成物.
已知强酸、强碱、盐的水溶液,溶质均以离子的形式存在.如图所示,a容器中是盐酸,b容器中是氢氧化钠溶液,c溶器中是反应生成物.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
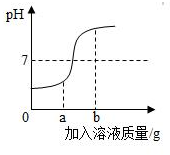 在用稀盐酸和氢氧化钠 进行中和反应实验时,溶液的酸碱度变化如图所示.
在用稀盐酸和氢氧化钠 进行中和反应实验时,溶液的酸碱度变化如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
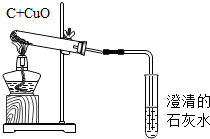 利用如图进行活性炭还原氧化铜的实验.
利用如图进行活性炭还原氧化铜的实验.| 反应物质量比(C:CuO) | 1:6 | 1:8 | 1:10 | 1:12 | |
| 固体变化 | 实验中 | 轻微红热 | 红热 | 红热 | 红热 |
| 实验后 | 砖红色粉末中有少量黑色固体 | 多量球状金属光泽固体 | 砖红色粉末中有细小光亮金属光泽球状固体 | 砖红色粉末中有部分黑色固体 | |
| 是否烘干 | 否 | 是 | |
| 固体变化 | 实验中 | 无明显现象 | 红热 |
| 实验后 | 大量黑色固体中有少量砖红色粉末 | 红色金属光泽球状固体小颗粒 | |
| 研磨时间(分钟) | 0 | 5 | 10 | |
| 固体变化 | 实验中 | 无明显现象 | 轻微红热 | 红热 |
| 实验后 | 砖红色粉末中有少量黑色固体 | 砖红色粉末中有多量细小红色金属光泽固体 | 有多量金属光泽红色球状固体 | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 海洋中的主要物质是氯化钠 | |
| B. | 可燃冰和锰结核是纯净物 | |
| C. | 可以用无色酚酞试液区别海水和蒸馏水 | |
| D. | 海水制镁发生的是化学变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com