
【题目】我国一些城市使用焦炉煤气作为生活燃料。以下实验流程是对焦炉煤气的成分进行局部 探究。下列说法不正确的是
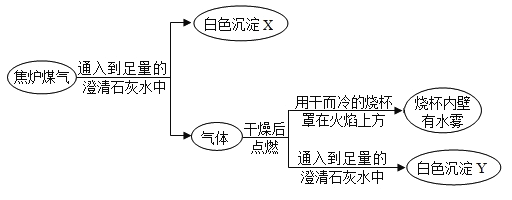
A.焦炉煤气可能含有 COB.X、Y 都是碳酸钙
C.上述流程中可能有化合反应发生D.焦炉煤气中一定含有 CO2 和 CH4
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】在质量守恒定律的课堂教学中,甲、乙、丙、丁四个组的同学分别做了A、B、C、D四个实验,他们都进行了规范的操作、准确的称量和细致的观察。
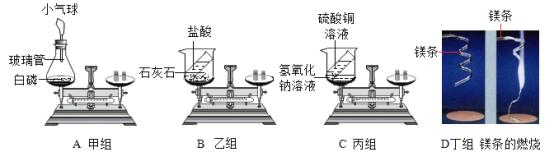
(1)A实验:在实验过程中观察到气球的变化是_____。
(2)A、B、C、D四个实验中,化学反应前后一定没有发生改变的是(填序号)_____。
①元素的种类
②元素的化合价
③物质的总质量
④物质的种类
⑤原子的个数
⑥原子的质量
(3)丙组同学认为C实验说明了质量守恒。反应为:![]() ,请你从原子的角度说明守恒的原因_____。
,请你从原子的角度说明守恒的原因_____。
(4)乙、丁两组同学得到的错误结论是“B.D实验说明质量不守恒”。老师引导学生分析了B、D两个实验的原因。你认为B实验不平衡的原因是_____;实验D中镁条燃烧的化学方程式_____。
(5)通过上述实验,你得到的启示:有气体参加或生成的反应,在验证质量守恒定律时应该注意的事项是:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请用化学用语填空:
(1)三个氯原子:_____;
(2)保持二氧化硫的化学性质的最小粒子_____;
(3) 2个镁离子_____;
(4)五氧化二磷中磷元素的化合价_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】食盐是一种重要的化工原料,请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
![]()
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和_____。
②在蒸发过程中,待_____时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
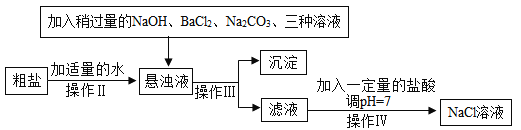
加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是(用化学方程式表示)_____,加入的三种溶液中,_____ 两种溶液可以用_____ 一种溶液替代。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是_____(已知:20℃时氯化钠的溶解度为36g)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小红按下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
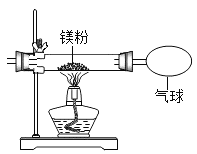
(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(作出猜想)黄色固体是Mg3N2。
(实验探究)设计实验,验证猜想:
实验操作 | 实验现象及结论 |
__________ | ___________ |
(反思与交流)①空气中N2的含量远大于O2的含量,可是镁条在空气中的燃烧产物MgO却远多于Mg3N2,合理的解释是________。
②同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液在生产生活中有着广泛的应用。
(1)0℃时,101Kpa 时氮气溶解度为 0.024,其意义 为:________。
(2)甲、乙两种固体物质的溶解度曲线如下图所示, 析出的晶体均不含结晶水,回答下列问题:
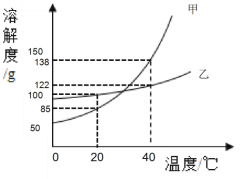
①乙物质的溶解性属于________(填“易溶”或 “可溶”或“微溶”或“无法确定”)。
②A 是 40℃含有 120g 水的甲溶液,经过如下操作, 得到 50g 甲固体。
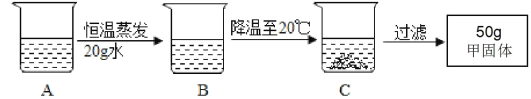
对以上过程的分析,正确的是________(选填编号)
a A 到 B 的过程中,溶质质量没有改变 b B 中溶质与溶剂的质量比为 138:100
c B 到 C 的过程中,溶质甲已全部析出 d A 溶液的质量等于 255g
③40℃,将甲、乙物质饱和溶液各 200g 降温至 20℃,对此过程判断一定正确的是________。
Ⅰ.现象:有析出晶体,甲溶液析出固体质量>乙溶液析出固体质量
Ⅱ.溶解度:溶解度都变小;20℃时:S 甲<S 乙
Ⅲ.溶液状态:都为饱和溶液;40℃:甲溶质的质量<乙溶质的质量
Ⅳ.溶剂变化:溶质质量不变;20℃时:甲溶液中溶剂质量>乙溶液中溶剂质量
④40℃,向 100g 水中加入 143g 甲物质,搅拌后发现全部溶解,但放置一段时间后又有少量 甲物质的晶体析出(不考虑甲与空气中的物质反应和水的蒸发),“全部溶解”的原因可能 是________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室配制50克质量分数为12%的氯化钠溶液。下图是小军实验操作过程示意图:
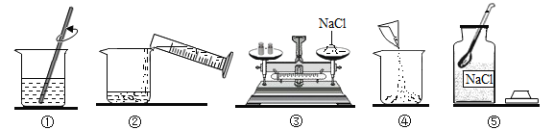
(1)请指出图中一处明显错误的操作_________;改正操作后,用上述图示的序号表示配制溶液的正确操作顺序________;
(2)图①中玻璃棒搅拌的目的是_______;
(3)配制该溶液需要用_________的量筒(填“50mL”、“100mL”或“200mL”)量取水。用己调节平衡的天平称取氯化钠固体时,发现指针偏右,接下来的操作是_______;
(4)经检验,该同学配制的溶液溶质质量分数偏小,可能的原因是_____ ( 填序号)
A 氯化钠固体不纯
B 用生锈的砝码称量
C 装瓶时有少量液体洒出
D 用量筒量取水时,俯视读数
E 溶解的烧杯提前用蒸馏水润洗
(5)将20克12%的氯化钠溶液配制成6%的氯化钠溶液,需加水______克。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】资料显示:在一定温度下,往煤中加入适量石灰石粉,其分解产物可使煤(含S)燃烧时产生的SO2转化成CaSO4,从而减少SO2排放,该方法被称为钙基固硫。某实验小组利用下列实验装置和药品对其可行性进行了模拟探究。
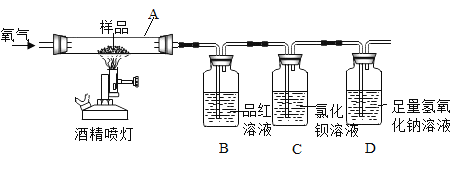
①SO2与CO2为非金属氧化物,均能与碱溶液反应,但SO2有毒,能与品红作用使其褪色。
②2SO2+2H2O+O2+2BaCl2=2BaSO4↓+4HCl
③CO2不与BaCl2溶液反应
(实验一)取S粉与CaCO3粉末的混合物装入A中,连续通入过量O2,加热至500℃左右,充分反应后,发现B中红色消失、C中出现大量的白色浑浊。
(1)停止实验的正确操作是_____。
(2)装置D中NaOH的作用是_____。
(实验二)另取上述S粉与CaCO3粉末的混合物装入A中,连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应后,发现B中红色消失,C中出现少量的白色浑浊。
(3)取反应后D中溶液滴加过量盐酸,出现大量无色气泡(其中有CO2)。反应结束后,经实验检验A中余下固体含有CaSO4,由此得知实验二过程中,A中发生的反应有三个,请完成剩余的两个化学方程式:
①S+O2![]() SO2;
SO2;
②_____;
③_____。
(实验三)另取CaSO4粉末装入A中,连续通入过量O2,加热至1200℃左右,充分反应,发现B中红色消失。
(4)比较实验一、二、三可知,如用该方法固硫,适宜的温度条件是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】九年级课外活动小组的同学们在期末复习时,来到化学实验室亲自对“质量守恒定律”进行了再次探究,如图是他们根据这一学期学过的化学反应分别设计的实验,请你一起参与他们的探究活动,并回答相关问题
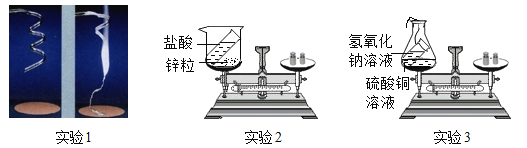
实验1:称量镁条,点燃,待反应结束后,再称量。
实验2:将盛有稀盐酸的小试管放入盛有锌粒的烧杯中称量,然后使稀盐酸与锌粒接触,充分反应后再称量实验3:将盛有氢氧化钠溶液的小试管放入盛有硫酸铜溶液的锥形瓶中称量,然后使氢氧化钠溶液与硫酸铜溶液混合,充分反应后再称量。
编号 | 实验1 | 实验2 | 实验3 |
反应前称重质量 | 9.6g | 212.6g | 118.4g |
反应后称重质量 | 16.0g | 212.4g | 118.4g |
(1)实验1观察到的现象是_______________;
(2)写出实验3反应的化学方程式________________;
(3)上述三个反应______________(填“符合”或“不符合”)质量守恒定律,实验___________正确反映了反应物与生成物的质量关系;
(4)由上述实验我们得到启示,探究_______________的反应验证质量守恒定律,实验必须在密闭的装置中进行;
(5)由质量守恒定律可知,化学反应前后,一定不变的是 _____________(填序号);
①物质种类 ②元素种类 ③原子种类 ④分子种类 ⑤分子数目 ⑥原子数目
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com