
| A. | 滤渣中至少含有两种金属 | |
| B. | 反应后得到滤渣的质量一定大于反应前加入的镁粉的质量 | |
| C. | 向滤渣中加入一定量稀盐酸,可能有气体生成 | |
| D. | 滤液中一定含有硝酸镁 |
分析 根据金属的性质进行分析解答,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换处理,据此解答.
解答 解:由于金属的活动性是:镁>铁>银,将镁粉加入到硝酸银、硝酸亚铁的混合物中,则镁首先与硝酸银反应生成了硝酸镁和银,当硝酸银完全反应后,再与硝酸亚铁反应,生成了硝酸镁和铁,由于得到的滤液为无色,则滤液中不含有硝酸亚铁.溶液中的银和铁全部置换出来,所以:
A、滤渣中至少含有银和铁两种金属,故A正确;
B、反应后得到银和铁,质量一定大于反应前加入的镁粉的质量,故B正确;
C、由于滤渣中含有铁,向滤渣中加入一定量稀盐酸,一定有气体生成,故C错误;
D、滤液中一定含有硝酸镁,故D正确.
故选C.
点评 本题考查的是常见的金属的性质,完成此题,可以依据已有的金属的性质以及金属活动性顺序的意义进行.


 53天天练系列答案
53天天练系列答案科目:初中化学 来源: 题型:推断题
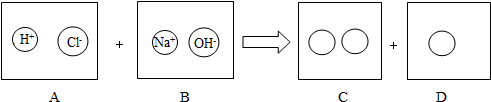
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用3%的过氧化氢溶液进行伤口消毒时常看到有气泡产生,是因为H2O2分解产生了O2 | |
| B. | 压瘪的乒乓球放入热水重新鼓起,是因为球内的气体分子间隙大 | |
| C. | 灭火时将水喷成细雾状,主要目的是隔离氧气 | |
| D. | 野营篝火时通常将木柴架空,主要是增大木柴与空气的接触面积 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | CO2气体(CO) | 过量的氧气 | 点燃 |
| B | Fe2O3(Fe) | 足量的盐酸 | 过滤 |
| C | FeSO4溶液(CuSO4) | 足量的锌 | 过滤 |
| D | O2(H2O) | 浓硫酸 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
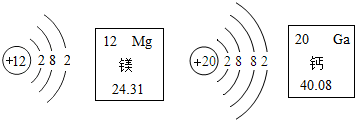
| A. | 镁元素的相对原子质量为12 | |
| B. | 在化学反应中,镁原子容易失去2个电子 | |
| C. | 在元素周期表中,镁元素和钙元素属于同一个族 | |
| D. | 钙离子核内有20个质子 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
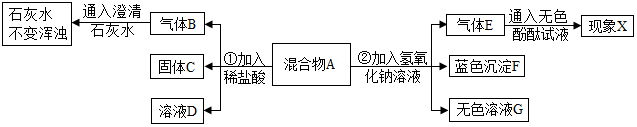
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
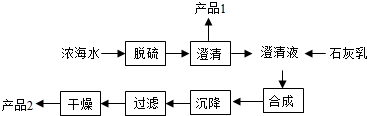
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
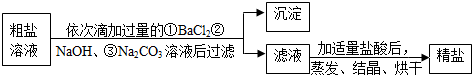
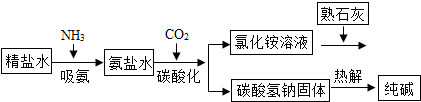
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com