
| 浓度限值(mg/m3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
分析 (1)根据化学反应前后原子的种类和数目不变求X的化学式;
(2)依据配制溶液所需的仪器分析判断;
(3)依据生成沉淀的质量可计算反应的硫酸的质量,而依据硫酸的质量可计算所取空气中二氧化硫的质量,进而判断二氧化硫的级别.
解答 解:(1)观察该反应SO2+Cl2+2H2O=2X+H2SO4,可知反应前硫原子是1个,氯原子是2个,氧原子是4个,氢原子是4个;反应后除2X外,硫原子是1个,氢原子是2个,氧原子是4个,根据化学反应前后原子的种类和数目不变,2X中应有2个氯原子和2个氢原子,因此X的化学式为HCl;故填:HCl;
(2)配制溶液所需的玻璃仪器主要有烧杯、玻璃棒、胶头滴管和量筒;故填:玻璃棒、胶头滴管和量筒;
(3)设溶液中H2SO4的质量为x
H2SO4+BaCl2=BaSO4↓+2HCl
98 233
x 0.233g
$\frac{98}{x}=\frac{233}{0.233g}$
x=0.098g
设100m3空气样品中SO2的质量为y
SO2+Cl2+2H2O=2HCl+H2SO4
64 98
y 0.098g
$\frac{64}{y}=\frac{98}{0.098g}$
y=0.064g
SO2的浓度:$\frac{0.064g}{100{m}^{3}}$=0.64mg/m3>0.50mg/m3,为三级标准.
点评 此题是对酸雨相关的知识考查,其中涉及到根据化学方程式的基本计算,在最后与级别标准对比时要注意:根据化学方程式计算所得值为100m3空气中二氧化硫的质量,还需要转换成标准值.


科目:初中化学 来源:江苏省无锡市长泾片2017届九年级下学期第二次模拟考试化学试卷 题型:选择填充题
以下归纳和总结完全正确的一组是
A.对现象的认识 | B.对安全的认识 |
①镁在空气中燃烧生成白色固体 ②紫色石蕊溶液能使稀盐酸变红 ③羊毛灼烧后有烧焦羽毛气味 | ①霉变的大米必须洗净后方可食用 ②可燃性气体点燃前必须验纯 ③家中天然气泄漏立即关闭阀门轻轻开窗 |
C.对原理等的认识 | D.对科学家贡献的认识 |
①用洗涤剂清洗油污是利用溶解的原理 ②闻到花香是因为分子在不停地运动 ③用排水法收集氧气,是因为氧气难溶于水 | ①拉瓦锡——测定空气的组成 ②门捷列夫——元素周期律的发现 ③道尔顿——原子论的创立 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | M | N | X | Y |
| 反应前质量/g | 2 | 20 | 34 | 0 |
| 反应后质量/g | 2 | 38 | 0 | 16 |
| A. | 该反应属于分解反应 | B. | 该反应属于化合反应 | ||
| C. | M在反应中可能作催化剂 | D. | 该反应生成的N、Y的质量比为9:8 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 质子 | 中子 | 电子 | |
| A | 14 | 14 | 14 |
| B | 26 | 30 | 24 |
| C | 26 | 30 | 26 |
| D | 14 | 16 | 14 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度(℃) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
| 氯化钠(克) | 35.7 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| 温度(℃) | 0 | 10 | 20 | 30 | … | 90 | |
| 纯碱(克) | 7.1 | 12.5 | 21.5 | 38.8 | … | 43.9 | |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
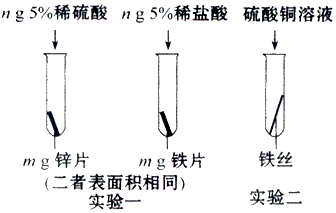
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
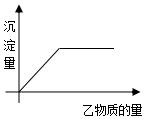 向甲物质中加入(或通入)乙物质,生成的沉淀量与所用的乙物质的量关系如图,则表中不符合条件的一组是( )
向甲物质中加入(或通入)乙物质,生成的沉淀量与所用的乙物质的量关系如图,则表中不符合条件的一组是( )| 组别 | 甲 | 乙 |
| A | FeCl3溶液 | NaOH溶液 |
| B | NaOH溶液 | CO2气体 |
| C | CuSO4溶液 | BaCl2 |
| D | 一定量海水 | AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 往溶液中加BaCl2溶液生成不溶于硝酸的白色沉淀,说明溶液中一定含SO42- | |
| B. | 浓硫酸能使纸张碳化变黑,说明浓硫酸具有吸水性 | |
| C. | 氯化钠晶体不导电,说明氯化钠晶体中不存在自由移动的离子 | |
| D. | 溶液中加稀盐酸,有能使澄清石灰水变浑浊的气体放出,说明溶液中有CO32- |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
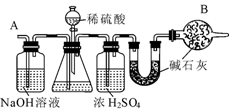
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com