
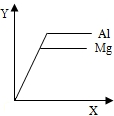
 如图表示等质量的镁条和铝条分别与足量且质量分数相等的稀硫酸反应的某种关系,下列说法中能正确表示图中横、纵坐标意义的是
如图表示等质量的镁条和铝条分别与足量且质量分数相等的稀硫酸反应的某种关系,下列说法中能正确表示图中横、纵坐标意义的是 解:A、两种金属的活动性不相同,所以它们反应所需的时间也不相同,当横坐标为时间时,正确的如下图,故A错;
解:A、两种金属的活动性不相同,所以它们反应所需的时间也不相同,当横坐标为时间时,正确的如下图,故A错;

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:0110 期末题 题型:填空题
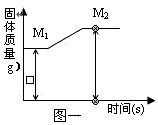
查看答案和解析>>
科目:初中化学 来源:2010年5月江苏省扬州市高邮市赞化学校九年级冲刺满分化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com